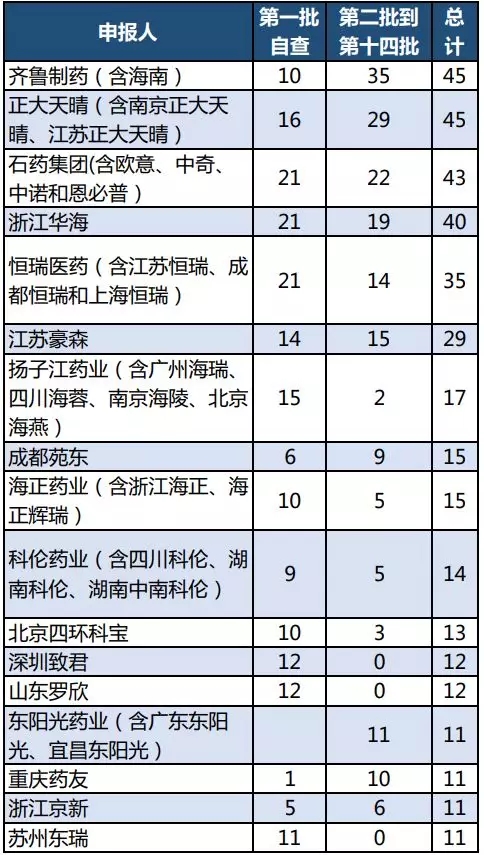
医药网7月19日讯 回顾此前新康界发布的14批临床数据自查核查情况一览:第一梯队有齐鲁、天晴、石药、华海……。截至2018年6月10日,从自查核查整体受理号数情况来看,排名前五的企业中,齐鲁制药、正大天晴、石药集团三家都是第二批到第十四批自查的受理号数多于第一批自查。
第二批到第十四批自查的受理号数大于10个的企业有齐鲁制药、正大天晴、石药集团、浙江华海、恒瑞
医药、江苏豪森、东阳光药业和重庆药友。与此相对,深圳致君、山东罗欣和苏州东瑞在第一批自查之后再无受理号进入自查。扬子江药业也只有2个受理号进入自查。
回顾:表1 自查受理号数和排名前列企业
数据来源:咸达药海遨游数据库
如表1所示,第二批到第十四批受理号数多过10个的
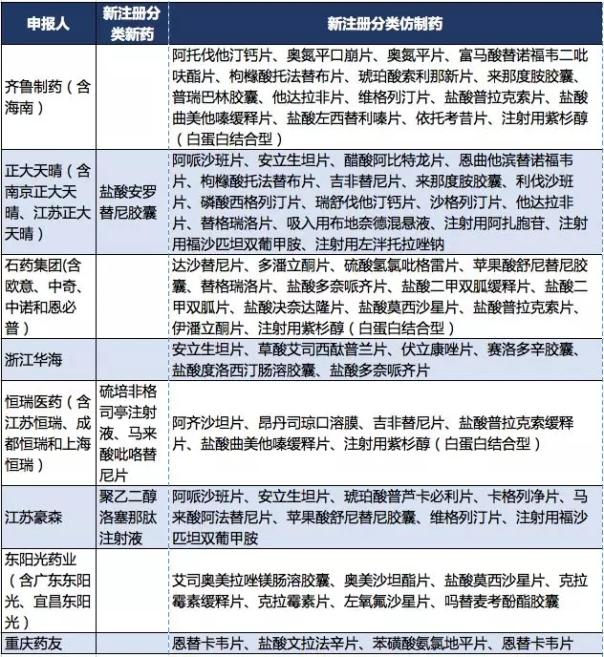
企业共8家。以新注册分类定义的新药和仿制药,并且不在第一批自查名单的产品,如表2所示,仅正大天晴、恒瑞医药和江苏豪森有新药进入第二批到第十四批自查。其中,正大天晴的盐酸安罗替尼胶囊和恒瑞的硫培非格司亭注射液都已经获批。
八家企业主要还是以仿制药申报为主,个别产品重合率较高,如注射用紫杉醇(白蛋白结合型)。从产品类型来看,主要申报的仿制药有两类,一是首仿药,如枸橼酸托法替布片、沙格列汀片、他达拉非片;二是中美/欧双报的销售潜力较大的国内上市家数较多的产品,如东阳光、石药和华海的产品。
表2 第二批到第十四批受理号数较多的企业申报产品
数据来源:咸达药海遨游数据库
 研发追踪
研发追踪
 新康界
新康界
 2018.07.19
2018.07.19
 5133
5133

 新浪医药
新浪医药
 2018.07.12
2018.07.12
 34308
34308

 医药地理
医药地理
 2018.10.22
2018.10.22
 18807
18807

 医谷
医谷
 2019.03.18
2019.03.18
 18732
18732