 产业资讯
产业资讯
 医谷
医谷
 2021.12.03
2021.12.03
 1735
1735
12月1日,VBI Vaccines公司宣布,美国食品药物监督管理局(FDA) 已批准乙型肝炎疫苗(重组)PreHevbrio,用于预防 18 岁及以上成人由所有已知乙型肝炎病毒 (HBV) 亚型引起的感染。这是目前FDA批准的第一款靶向三种乙肝病毒抗原的成人HBV疫苗。

来源:VBI Vaccines公司官网
乙型肝炎是世界上受威胁最严重的传染病之一,世界卫生组织估计,目前全球估计约有2.96亿人患有慢性乙肝感染,且每年新增病例达150 万。HBV感染是导致肝病的主要原因,并且以目前的治疗方法很难治愈,许多患者会继续发展为肝癌。据估计,每年有 90万人死于慢性 HBV 的并发症,例如肝功能代偿失常、肝硬化和肝细胞癌。
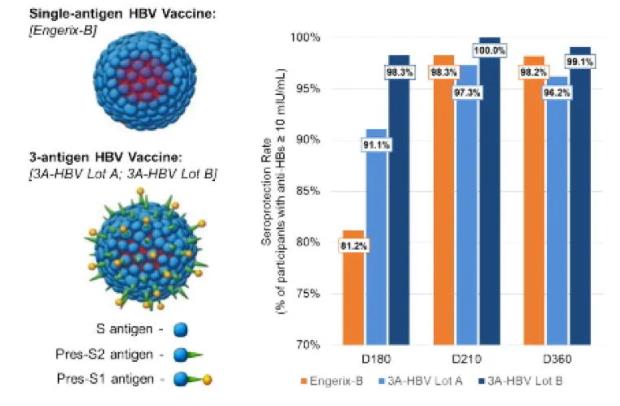
PreHevbrio是VBI Vaccines开发的第三代乙肝疫苗,它是一种含有HBV的Pre-S1,Pre-S2和S表面抗原的类病毒颗粒(VLP),具有更好的免疫原性,可在两次或三次免疫后引发强烈的血清保护作用。
此次FDA批准主要是基于两项 III 期试验PROTECT 和 CONSTANT的积极结果。临床研究对PreHevbrio与单抗原HBV疫苗Engerix-B进行了比较。
PROTECT研究的数据显示,PreHevbrio在18岁及以上的所有受试者中的血清保护率为 91.4%,而 Engerix-B 在 18 岁及以上的所有受试者中仅为 76.5%。在 45 岁及以上年龄组中,PreHevbrio 保持优势,为 89.4%,而 Engerix-B 为 73.1%。两项研究的综合安全性分析证明了PreHevbrio有良好的耐受性,且未发生非预期不良事件,所有年龄组中最常见的不良事件是注射部位疼痛和压痛、肌痛和疲劳,所有这些症状通常在 1-2 天内无需干预即可解决。
来源:sciencedirect
这两项研究分别发表在The Journal of the American Medical Association Network Open (《美国医学会杂志在线公开》) (2021 年 10 月)和The Lancet Infectious Diseases(《柳叶刀传染病》杂志) (2021 年 5 月)。
据悉,随着 FDA 的批准,VBI Vaccines预计到2022年第一季度将在美国推出 PreHevbrio。其合作伙伴 Syneos Health 将帮助其实现在美国上市的商业化。除了FDA,VBI Vaccines公司正推进PreHevbrio在欧洲药品管理局 (EMA)的上市许可申请。同时,预计将在 2022 年完成向英国药品和保健品监管局 (MHRA) 和加拿大卫生部提交的监管申请。

 CPhI制药在线
CPhI制药在线
 2018.07.24
2018.07.24
 49634
49634

 艾美仕
艾美仕
 2018.07.09
2018.07.09
 34678
34678


 2014.03.11
2014.03.11
 31102
31102