 会员动态
会员动态
 Insight数据库
Insight数据库
 2022.05.13
2022.05.13
 1874
1874
5 月 13 日,NMPA 最新批件显示,君实的特瑞普利单抗第 5 项适应症获批上市,联合紫杉醇/顺铂一线治疗晚期或转移性食管鳞癌。

目前,特瑞普利单抗 已获批和申报的适应症如下:
君实生物 PD-1 单抗获批适应症
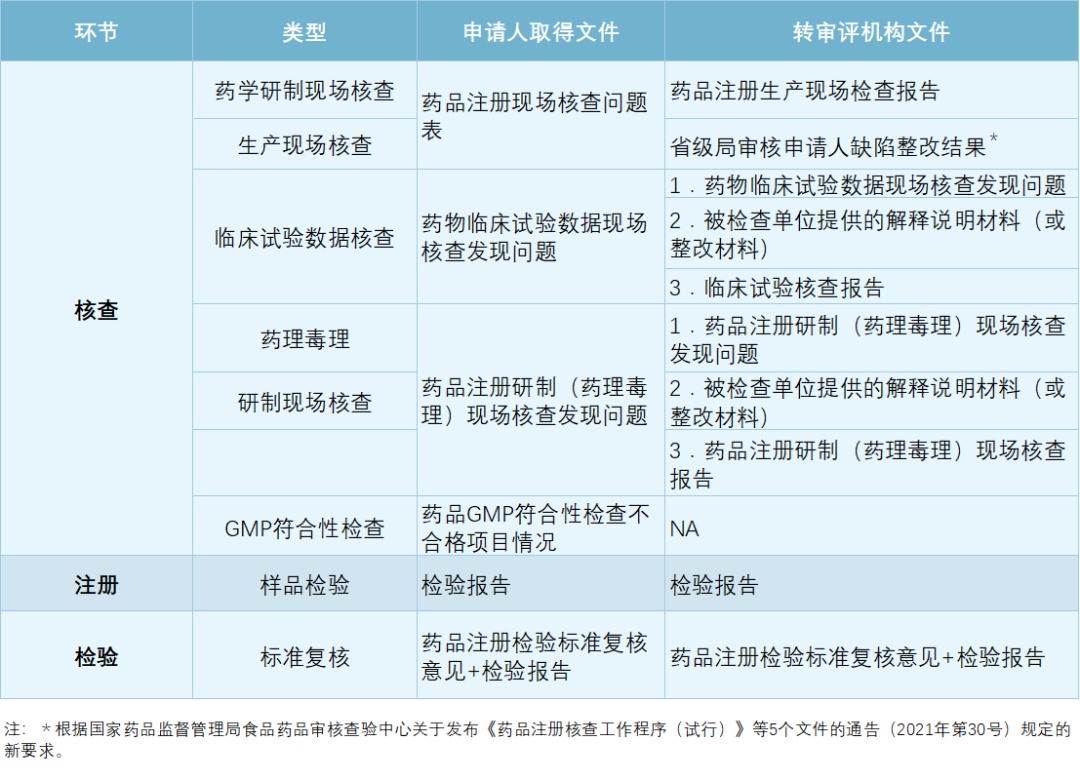
来自:官方公告,Insight 整理
值得一提的是,相较于既往获批适应症,这是君实生物获批的第一个大癌种,也是特瑞普利单抗大适应症开发的一个开端。根据 2020 Globocan 最新数据,食管癌为国内新发癌种第 6 位,仅次于肝癌,年新发人数超过 32 万人;也是在国内癌症死亡中居于第 4 位,2020 年度死亡病例约 30 万。而食管鳞癌在中国食管癌患者中占到 90%。
中国地区 2020 年度新发癌种 TOP7
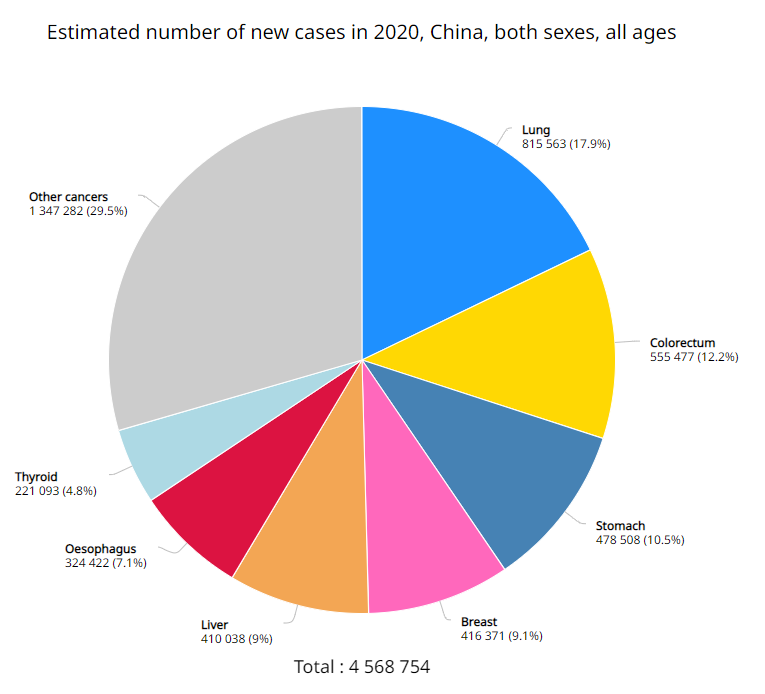
来自:Globocan,公众号回复「Cancer」即可下载报告
特瑞普利单抗一线治疗食管鳞癌的适应症上市申请基于 JUPITER-06 研究。这是一项随机、双盲、安慰剂对照、多中心的 Ⅲ 期研究(NCT03829969 / CTR20182314),旨在比较特瑞普利单抗联合紫杉醇/顺铂(TP 化疗)与安慰剂联合 TP 化疗在晚期或转移性 ESCC 一线治疗中的有效性和安全性。2021 ESMO 年会上,君实首次公布了该试验结果(编号:1373MO),显著改善了患者的生存获益,刷新了「最长中位总生存期」,有望成为该领域新的标准治疗方案。
JUPITER-06 研究共纳入 514 例未接受过治疗的晚期或转移性 ESCC 患者,随机分配至特瑞普利单抗联合化疗组(n=257)或安慰剂联合化疗组(n=257),分别接受特瑞普利单抗(240 mg)或安慰剂联合 TP 化疗方案(Q3W)治疗最多 6 个周期,随后接受特瑞普利单抗或安慰剂维持治疗。主要终点是由 BICR(盲态独立中心阅片)根据 RECIST v1.1 进行评估的无进展生存期(PFS)和总生存期(OS),次要终点为研究者评估的 PFS、客观缓解率(ORR)和缓解持续时间(DoR)等。
截至 2021 年 3 月 22 日,经 BICR 评估,特瑞普利单抗组和安慰剂组的中位 PFS 分别为 5.7 个月和 5.5 个月。特瑞普利单抗组的疾病进展或死亡风险降低了 42%(HR=0.58 [95% CI:0.461-0.738],P<0.00001),27.8% 的患者在 1 年内未发生疾病进展,获益比例是安慰剂组的 4 倍以上,后者仅为 6.1%。
同时,与单纯化疗相比,特瑞普利单抗联合化疗将患者的生存期显著延长,中位 OS 为 17.0 个月 vs. 11.0 个月,延长时间长达 6 个月。特瑞普利单抗组的患者死亡风险降低了 42%(HR=0.58 [95% CI:0.425-0.783],P=0.00036)。特瑞普利单抗组和安慰剂组的 1 年 OS 率分别为 66.0% 和 43.7%。
另外,此前君实曾表示计划与合作伙伴 Coherus 在 2022 年内向 FDA 提交特瑞普利单抗一线食管鳞癌适应症上市申请(sBLA)。不过日前该药在美国的首个上市申请收到 FDA 完整回复函(CRL),上市进度有了一定程度的后延,可能也会影响到一线食管鳞癌适应症的申报;同时 JUPITER-06 作为国内试验,入组人群均为中国人群,在信迪利单抗失利之后,其前景也相对不太明朗。

 豪森药业
豪森药业
 2019.05.08
2019.05.08
 27577
27577

 蒲公英
蒲公英
 2018.07.10
2018.07.10
 15473
15473

 生物制药小编
生物制药小编
 2018.06.27
2018.06.27
 14922
14922