 产业资讯
产业资讯
 医麦客
医麦客
 2022.06.23
2022.06.23
 3108
3108
2022年6月22日/医麦客新闻 eMedClub News/--据近日发布的Fact.MR研究报告称,预计从2022年至2032年,抗体偶联药物(ADC)的市场将以17.2%的年复合增长率增长,到2032年底,市场规模将超过390亿美元。而面对ADC百亿市场规模,已经有不少企业分到了“蛋糕”。
截至2021年年底,全球一共有14款ADC药物获批上市,涉及靶点11个,适应症涵盖实体瘤和血液瘤。据公开数据显示,2021年全球ADC药物的市场规模超过50亿美元。其中,Kadcyla(恩美曲妥珠单抗)和Adcetris(维布妥昔单抗) 两款上市时间较早的药物,分别以21.78亿美元和13.06亿美元的销售额占据绝对优势。此外,第一三共/阿斯利康的Enhertu和吉利德的Trodelvy表现也较为亮眼。
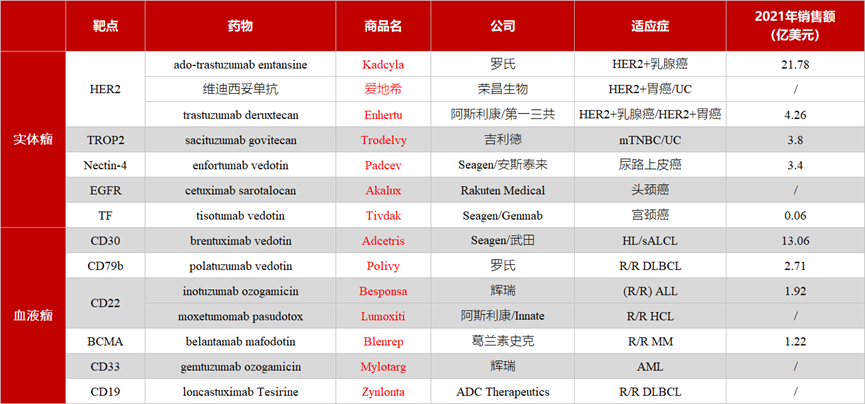
▲ 已获批的14款ADC药物及2021年销售额
2022年3月,第一三共/阿斯利康的Enhertu(DS-8201)的上市申请获得国家药品监督管理局(NMPA)受理。2022年6月,云顶新耀的Trop2 ADC疗法注射用戈沙妥珠单抗(Trodelvy;IMMU-132)获批上市,用于治疗接受过至少两种系统治疗(其中至少一种为针对转移性疾病的治疗)的不可切除的局部晚期或转移性三阴性乳腺癌(TNBC)成人患者,这也是国内首款获批的Trop2 ADC。
国内处于临床后期的ADC候选药物
目前,国内获批上市ADC药物所针对的适应症不相同,之间的竞争并不算激烈。但随着ADC市场的增长、政策的利好、技术与人才的支持,国内ADC候选药物的研发竞争俨然已进入新时代,目前已有多款ADC候选药物处于临床后期试验阶段。

▲ 国内处于临床后期的ADC候选药物
TAA013TAA013是由东曜药业自主研发的一款靶向HER2的候选ADC药物,旨在成为Kadcyla的实惠替代药物,用于治疗HER2阳性乳腺癌。TAA013由曲妥珠单抗和美坦新衍生物组成,能够靶向HER2阳性的乳腺癌组织,发挥肿瘤杀伤作用。
2021年公布在CSCO会议上的TAA013的临床数据显示,在经过曲妥珠单抗、拉帕替尼、吡咯替尼等多线治疗的HER2阳性乳腺癌患者中,利用TAA013治疗后,ORR为10%,DCR达70%,中位PFS超过5个月。安全性方面,TAA013耐受性良好,未发生限制性毒副反应。
目前,TAA013的关键性Ⅲ期临床试验正在进行,预计将于2022年年底完成,并计划在2023年上市。
VB4-845VB4-845是齐鲁制药与美国Sesen Bio公司共同合作研发的一款ADC药物,是以肿瘤细胞表面的上皮细胞粘附分子(EpCAM)抗原为靶点的人源化scFv免疫毒素,一旦结合癌细胞表达的EpCAM就会被内化至细胞质中,诱导细胞凋亡。拟用于治疗高风险的、卡介苗(BCG)治疗失败的非肌层浸润性膀胱癌(NMIBC)。
据Sesen Bio此外公布的临床数据显示,在接受治疗3个月后,高风险NMIBC原位癌患者的ORR达到40%,NMIBC乳头状癌患者的无复发率达到71%,76%的患者可以3年内不需要彻底切除膀胱。2021年2月,美国FDA已接受VB4-845的BLA。2021年7月,VB4-845在复旦大学附属肿瘤医院完成中国III期临床试验的首例患者给药。
IMGN853IMGN853是华东医药与美国ImmunoGen合作研发的一款全球首个针对叶酸受体α(FRα)阳性卵巢癌的ADC候选药,由FRα结合抗体、美登木素生物碱DM4、连接子偶联而成,用于治疗FRα高表达的铂耐药卵巢癌。
2022年3月,ImmunoGen公布了IMGN853用于治疗卵巢癌的美国关键性单臂临床试验(“SORAYA试验”)的全部研究结果:试验已达到主要研究终点,确认的ORR为32.4%,其中有5例完全缓解;DOR为6.9个月,并且具有良好的安全性。
基于此,ImmunoGen已向FDA提交了IMGN853的BLA,用于单药治疗先前接受过1至3次全身治疗的铂类耐药和高叶酸受体-α表达的卵巢癌患者。目前,IMGN853在中国的临床试验申请已于2021年3月获批,包括一项国际多中心随机对照Ⅲ期研究和一项评价该药物在中国成人患者中的安全性、耐受性和药代动力学的Ⅰ期研究。
SAR408701SAR408701是赛诺菲自主研发的一款靶向CEACAM5的ADC,由人源化抗体SAR408377和细胞毒性药物美登素DM4通过ImmunoGen开发的可切割链接子偶联而成。
2020年ASCO会议上公布的I/II期临床试验结果显示,接受过SAR408701治疗的CEACAM5高表达患者的ORR为20.3%,DCR为64.1%,中位DOR为5.6个月;中等表达患者的ORR为7.1%,DCR为60.7%。尽管在疗效上表现不算亮眼,但相比于抗微管化疗药多西他赛,该药物具有作为二线治疗方案的潜力。目前,该药物单药治疗NSCLC的III期临床试验正在开展。
Polivy/RG7596Polivy是由罗氏旗下基因泰克研发的靶向CD79b的首创ADC候选药物,由一种人源化抗CD79b抗体与抗有丝分裂剂MMAE(单甲基阿司他丁E)偶联而成,被开发用于治疗淋巴瘤。于2019年6月获美国FDA批准上市。
2021年11月,一项随机、双盲、安慰剂对照的国际关键III期POLARIX临床试验(NCT03274492)的阳性结果在美国ASH年会上公布,结果显示:与R-CHOP治疗组相比,Polivy+R-CHP治疗组疾病进展、复发或死亡的相对风险显著降低了27%。
据悉,该药物已于2020年8月在博鳌落地,且已有患者通过批准先行使用该药物进行治疗。而基于关键III期的结果,相信未来Polivy也定将在中国获批上市。
Blenrep/GSK2857916GSK2857916是葛兰素史克研发的一款ADC候选药物,由人源化抗BCMA单克隆抗体与细胞毒制剂Auristatin F通过不可切割链接子偶联而成。被开发用于治疗R/R MM和BCMA高表达的晚期血液肿瘤。已于2020年8月获美国FDA批准上市。
一项关于GSK2857916治疗已接受过多种前期疗法的R/R MM患者的II期临床试验结果显示,该候选药物的2.5mg/kg剂量组的ORR为31%,其中,18例患者获得了非常好的部分缓解或更好的缓解(≥VGPR);3.4mg/kg剂量组的ORR为34%;且整体安全性良好。
2020年5月,中国CDE批准了葛兰素史克的GSK2857916的临床试验申请,适应症为联合硼替佐米和地塞米松,用于治疗至少接受过一种既往治疗的多发性骨髓瘤成人患者。目前,该候选药物在中国也已处于临床后期,有望早日获批上市。
ARX788ARX788是浙江医药旗下新码生物与美国Ambrx合作研发的新一代靶向HER2的ADC药物,由毒素小分子AS269和抗HER2单克隆抗体两部分组成,能够有效抑制细胞分裂、诱导细胞死亡。同时,采用了非天然氨基酸定点偶联技术,提升了ADC药物的稳定性。
2020年CSCO大会上,新码生物公布了ARX788治疗HER2阳性晚期乳腺癌患者的Ⅰa期临床数据,1.5mg/kg治疗组患者客观缓解率(ORR)为68.4%,疾病控制率(DCR)达100%,且ARX788耐受性良好,59名受试者中仅出现7例与药物相关的≥3级不良反应,无DLT发生,尚未达到最大耐受剂量(MTD)。
2021年1月,ARX788获得FDA授予快速通道资格,用于治疗已接受过一种或多种抗HER2治疗的晚期或转移性HER2阳性乳腺癌;2021年3月,获得FDA授予孤儿药资格,用于治疗HER2阳性胃癌和胃食道结合部癌;2021年5月,被CDE纳入突破性治疗品种。
2021年2月,ARX788获批开展用于胃癌和胃食管结合部腺癌治疗的Ⅱ/Ⅲ期临床试验。2022年4月,ARX788的临床试验申请(IND)获批(受理号:CXSL2200080),用于治疗HER2表达或突变晚期实体瘤。据消息称,ARX788有望在今年递交单药治疗HER2阳性晚期乳腺癌的上市申请。
总结
总体看来,我国的ADC领域发展方兴未艾,其中合作引进的产品较多,国内企业自主研发的较少。候选产品中,针对HER2靶点和乳腺癌适应症的竞争相对激烈。
未来,ADC市场规模还将持续扩增,已处于临床后期阶段的这些候选产品或将会中国市场中取得不错的收益,同时,我国本土的生物医药企业也需要从差异化创新以及自主研发方面去考虑如何在百亿市场规模里占据一席之地。
以上7款III期在研ADC候选药物,你认为谁会最先获批?欢迎留言讨论
参考资料:
1.https://www.biospace.com
2.各企业官网

 CPhI制药在线
CPhI制药在线
 2018.07.24
2018.07.24
 49639
49639

 艾美仕
艾美仕
 2018.07.09
2018.07.09
 34683
34683


 2014.03.11
2014.03.11
 31103
31103