 产业资讯
产业资讯
 医药笔记
医药笔记
 2022.06.30
2022.06.30
 2146
2146
2022年6月29日,康方生物PD-1/CTLA-4双抗卡度尼利单抗(AK104)获得NMPA批准上市,用于治疗既往接受含铂化疗治疗失败的复发或转移性宫颈癌患者。卡度尼利单抗成为首个获批上市的国产双抗,也是全球首款PD-1/CTLA-4双抗。
卡度尼利单抗此次获批是基于一项卡度尼利单药用于既往接受含铂化疗治疗失败的复发或转移性宫颈癌的Ⅱ期关键性临床研究。截至2021年8月5日,来自全国36家中心共111例晚期宫颈癌患者入组,接受卡度尼利6mg/kg 静脉输注,每2周1次给药。结果显示,经IRRC确认的ORR为33.0%,其中完全缓解(CR)率为12.0%,6个月和12个月持续反应时间(DoR)率分别为77.6%和52.9%。中位PFS为3.75个月,中位OS为17.51个月。亚组分析中,在PD-L1阳性(CPS≥1)患者中,ORR为43.8%,中位PFS为6.34 个月,中位OS未达到。安全性方面上,≥3级TRAE发生率为27.0%,患者耐受性好。

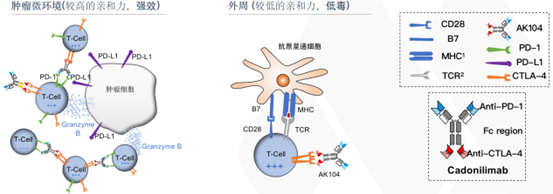
卡度尼利单抗基于康方生物Tetrabody双抗技术构建,独特的分子设计成为迭代的基础。卡度尼利为四价设计,可以与肿瘤微环境中共表达有PD-1和CTLA-4的T细胞间进行多价结合,与共表达较少的外周T细胞相比结合更牢。因此,卡度尼利单抗更容易逐步富集在肿瘤微环境中,使正常组织分布浓度降低,有望大幅减少不良反应,提高安全性。
总结
目前宫颈癌患者二线治疗的中位总生存约5~9个月,卡度尼利带来了近8~13个月的总生存期的延长,为中国患者带来了颠覆性的治疗选择。值得注意的是,卡度尼利治疗复发转移性宫颈癌的上市申请于2021年9月获得NMPA受理并获优先审评,至2022年6月获批上市,上市审批时间仅用9个月,审评速度远快于其他创新药16个月的平均审评周期,体现了卡度尼利优异的抗肿瘤疗效及康方生物高效的执行力。

 CPhI制药在线
CPhI制药在线
 2018.07.24
2018.07.24
 49632
49632

 艾美仕
艾美仕
 2018.07.09
2018.07.09
 34675
34675


 2014.03.11
2014.03.11
 31102
31102