 研发追踪
研发追踪
 Medaverse
Medaverse
 2022.07.25
2022.07.25
 4144
4144
7月20日,新泽西州,PTC Therapeutics, Inc.(纳斯达克股票代码:PTCT)宣布,Upstaza™(eladocagene exuparvovec)已获得欧盟委员会的上市许可。Upstaza™是第一个获批的针对芳香族 L-氨基酸脱羧酶 (AADC) 缺乏症的疾病改善疗法,也是第一个直接注入大脑的上市基因疗法。它被批准用于18个月及以上的患者。上市许可适用于所有27个欧盟 (EXIT-OLD) 成员国,以及冰岛、挪威和列支敦士登。


Stuart W. Peltz
PTC Therapeutics首席执行官Stuart W. Peltz博士说:“今天欧盟委员会批准Upstaza用于治疗AADC缺乏症对患者、PTC以及更大的基因治疗社区来说都是重要的。我们很自豪能够将这种创新疗法推向市场,让患者受益。Upstaza是第一个也是唯一一个获批的针对AADC缺乏症患者的疾病改善疗法。我们准备尽快为患者提供这种期待已久的治疗方法尽可能。”

Stuart W. Peltz博士于1998年创立PTC Therapeutics。在他的领导下PTC已从一家研究机构成长为一家上市公司,拥有多种获批产品和强大的技术平台基础,继续为罕见疾病患者提供强大的发现管线。在创立PTC之前,Stuart在罗格斯大学分子遗传学和微生物学系担任教授。Stuart是RNA生物学和涉及mRNA转换和翻译的转录后控制过程的公认科学领导者。他在该领域积累了30多年的研究经验和100多篇出版物。
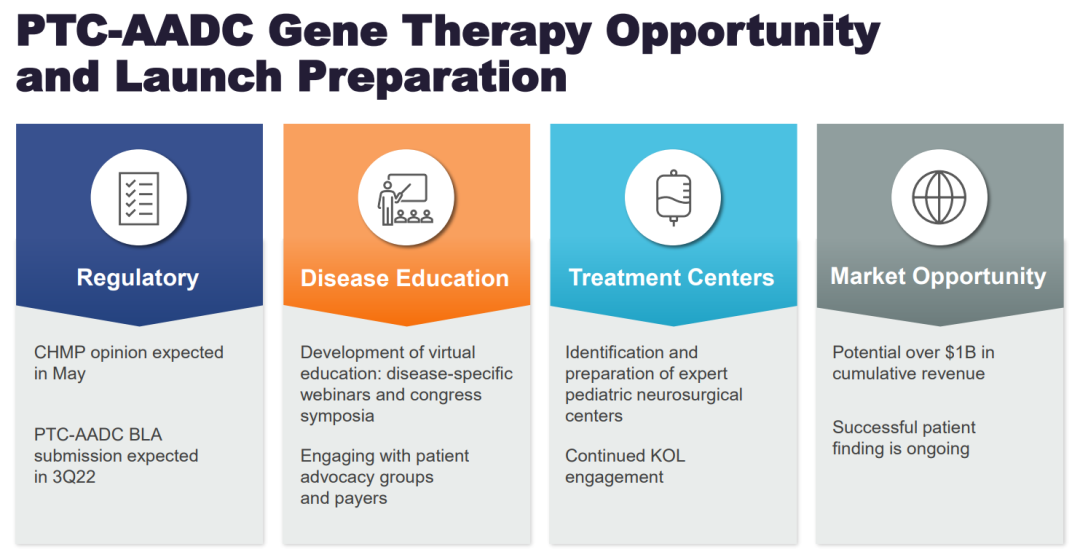
Upstaza™市场机会和上市准备
在Upstaza临床研究期间,患者从没有达到任何发育运动里程碑到早在治疗后三个月就表现出具有临床意义的运动技能,并且显示转化性改善在治疗后持续长达十年。此外,所有接受治疗的患者的认知技能都得到了提高。Upstaza还减少了可能导致危及生命和病态并发症的症状。
“在治疗之前,我们的女儿没有达到任何发育里程碑。她患有眼科危机,演变成数小时的疼痛,我们被告知她将终生卧床不起,”患者组织Teach RARE创始人Richard Poulin说,他的女儿是作为临床试验的一部分。“在接受Upstaza后,她现在可以说话、走路、跑步,甚至骑马。我们对EMA的批准感到兴奋,并希望这一里程碑能给其他受AADC缺陷影响的儿童和家庭带来希望。”
关于Upstaza ™(eladocagene exuparvovec)
Upstaza前身为PTC-AADC,是一种用于治疗AADC缺乏症的一次性基因替代疗法。它是一种基于重组腺相关病毒血清型2 (AAV2) 的基因疗法,包含人类DDC基因。它旨在纠正潜在的遗传缺陷,通过将功能性DDC基因直接递送到壳核中,增加AADC酶并恢复多巴胺的产生。
Upstaza的疗效和安全性已在临床试验和同情使用计划中得到证明。第一位患者在10多年前接受了给药。在临床试验中,Upstaza 展示了转化性神经系统改善,并在治疗后持续了长达9年。最常见的副作用是最初的失眠、易怒和运动障碍。CHMP提出的批准的完整适应症是:Upstaza 适用于治疗年龄在18个月及以上且临床、分子和基因证实诊断为芳香族L-氨基酸脱羧酶 (AADC) 缺乏症且具有严重表型的患者。
Upstaza的给药是通过立体定向外科手术进行的,这是一种微创神经外科手术,用于治疗许多儿科和成人神经系统疾病。Upstaza给药程序将由专业立体定向神经外科中心的合格神经外科医生执行。
关于芳香族 L-氨基酸脱羧酶 (AADC) 缺乏症
AADC缺乏症是一种致命的罕见遗传疾病,通常会导致严重的残疾和生命最初几个月的痛苦,影响生活的各个方面——身体、心理和行为。AADC缺乏症儿童的痛苦可能因以下原因而加剧:令人痛苦的癫痫样眼科危机发作,这种情况可能每天发生并持续数小时,导致眼睛在头部翻卷、频繁呕吐、行为问题、睡眠困难和危及生命的并发症,例如呼吸道感染和胃肠道问题。
没有批准用于AADC缺乏症的疾病改善治疗,受影响儿童的生命受到严重影响,并缩短,使用许多不同的药物来帮助控制症状。通常还需要进行持续的物理、职业和言语治疗,以及包括手术在内的干预措施,以管理可能危及生命的并发症,例如感染、严重的喂养和呼吸问题以及脊柱侧弯。

原文链接:
Upstaza™ Granted Marketing Authorization by European Commission as First Disease-Modifying Treatment for AADC Deficiency

 新浪医药
新浪医药
 2018.07.12
2018.07.12
 34354
34354

 医药地理
医药地理
 2018.10.22
2018.10.22
 18824
18824

 医谷
医谷
 2019.03.18
2019.03.18
 18771
18771