 产业资讯
产业资讯
 火石创造
火石创造
 2022.08.10
2022.08.10
 1515
1515
2022年7月,全球批准新药数量略为低迷。FDA批准9款新药(NDA/BLA),但新分子实体药物(NDA:Type 1 - New Molecular Entity)和生物制品药物(BLA)本月均无;EMA新授权5款药品上市,无新活性物质(NAS)上市;NMPA批准1款创新药上市,属生物制品,为乐普生物的普特利单抗注射液。
医疗器械方面,FDA有3个通过上市前批准(PMA)途径首次上市的产品。境内公示了6个三类医疗器械进入创新审批绿色通道,批准了5个创新器械上市,境内医疗器械审批集中在体外诊断试剂,共813项,占33.53%。
全球药品获批情况
(一)美国FDA批准情况
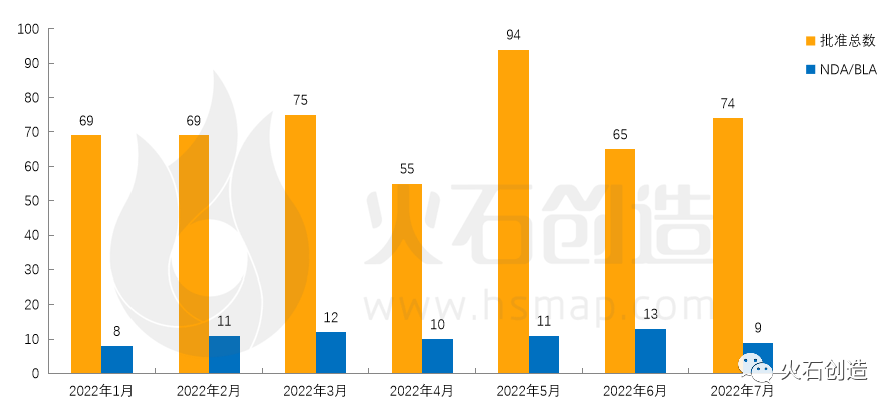
图1: 2022年1—7月FDA药物批准数量变化情况
来源:美国食品药品监督管理局
如图1,截至2022年8月5日FDA官网披露,2022年7月FDA共完成74项药品首次批准(不包含暂时批准),其中NDA/BLA批准9款(不包含暂时批准),见表1。本月新获批的新分子实体药物(NDA:Type 1 - New Molecular Entity)和生物制品药物(BLA)均为0款。
其中ZORYVE是一款每日一次的无类固醇乳膏,是第一个也是唯一一个被批准用于治疗斑块型银屑病,包括间擦性银屑病(又称为反向银屑病)的局部外用磷酸二酯酶4(PDE4)抑制剂,可快速清除银屑病斑块并减轻身体所有受影响区域的瘙痒。
表1:2022年7月FDA批准NDA/BLA药物列表

来源:美国食品药品监督管理局
(二)欧盟EMA批准情况
截至2022年8月5日EMA官网披露,2022年1月至7月的推荐上市药品及新活性物质(NAS)数量情况见图2。2022年7月EMA未推荐药品上市。

图2: 2022年1—7月EMA推荐上市药品数量变化情况
来源:火石创造产业数据中心
截至2022年8月5日,EMA在7月新授权5款药品上市,见表2。
其中Kinpeygo是在欧洲获批的第一种也是唯一一种成人原发性免疫球蛋白A(IgA)肾病(IgAN)治疗方法,被授予孤儿药资格;Zokinvy曾于2020-11-20获美国FDA批准上市,为全球第一个获批治疗早衰症和早衰样核纤层蛋白病(PL)的药物,此次欧盟也通过加速评估批准其上市。
表2: 2022年7月EMA授权药物列表
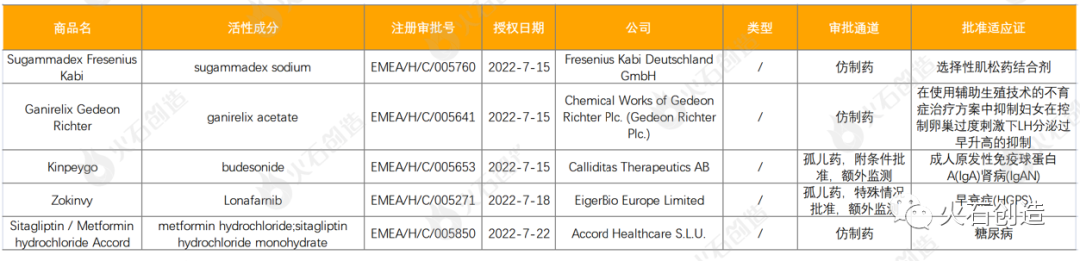
数据来源:火石创造产业数据中心
(三)NMPA批准情况
截至2022年8月5日NMPA披露,2022年7月共批准国产首次注册药品65件。按剂型去重后,共43个药品品种(不同厂家生产同一药物按同一品种计算)。本月有1款1类创新药获批,属生物制品。2022年7月NMPA批准的1类创新药情况见表3。
表3:NMPA批准的1类创新药获批列表

数据来源:国家药品监督管理总局
普特利单抗注射液(商品名:普佑恒™),是乐普生物旗下首款创新型抗PD-1单克隆抗体生物药,适用于不可切除或转移性的高度微卫星不稳定型(MSI-H)或错配修复缺陷型(dMMR)的晚期实体瘤患者。乐普生物分别于2021-07-05和2021-10-26向NMPA提交了普特利单抗注射液的2项适应症上市申请,分别用于治疗黑色素瘤(受理号:CXSS2101008)和MSI-H/dMMR实体瘤(受理号:CXSS2101041),其中CXSS2101041被纳入优先审评,通过附条件批准程序优先获批上市,其上市将为更多中国患者带来肿瘤免疫治疗新选择。
(四)仿制药一致性评价情况
截至2022年8月5日CDE官网披露,CDE共承办药品一致性评价受理号4089个,2022年7月共新增承办73个受理号。截至2022年8月5日,共4482个品规上市药品通过一致性评价(包含视同通过1868个品规),本月共117个品规的药品通过一致性评价(包含视同通过38个品规),按剂型去重后,共69个药品品种。
目前一致性评价品种通过的注射剂共1594个品规(248个品种),本月过评药品中共计63个品规(28个品种)的注射剂。2022年1月至7月通过一致性评价数量见图3。
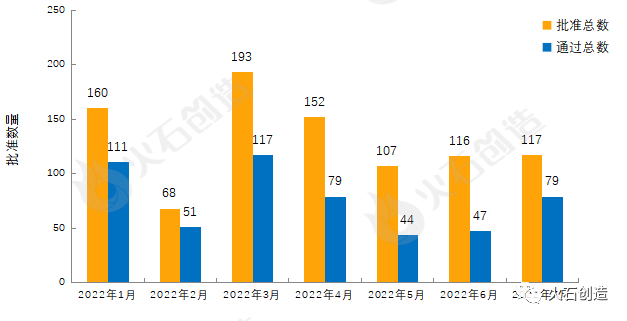
图3: 2022年1—7月仿制药一致性评价批准数量变化情况
来源:国家药品监督管理总局
全球医疗器械获批情况
(一)美国FDA批准情况
截至2022年8月5日,7月FDA共批准261个510(k)途径的产品,其中一类器械18个,二类器械234个,未分类9个。
通过对510(k)上市前通知的器械根据美国医学专业用途进行分类,结果发现,7月产品获批类型最多的为一般和整形手术器械、放射科器械、心血管器械、骨科器械与一般医院和个人使用类器械,见图4。
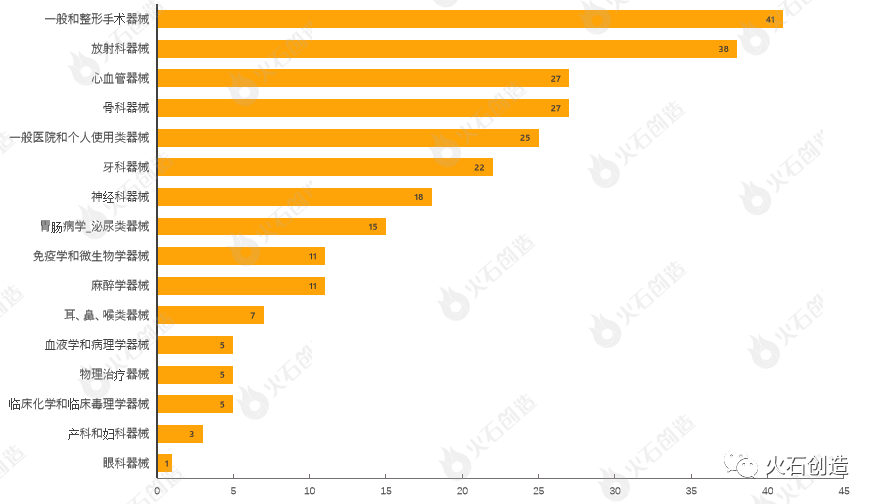
图4:2022年7月通过FDA 510(k)途径获批上市产品类型分布情况
来源:美国食品药品监督管理局
2022年7月有3个通过上市前批准(PMA)途径首次上市的产品。
表4:2022年7月PMA首次批准的器械
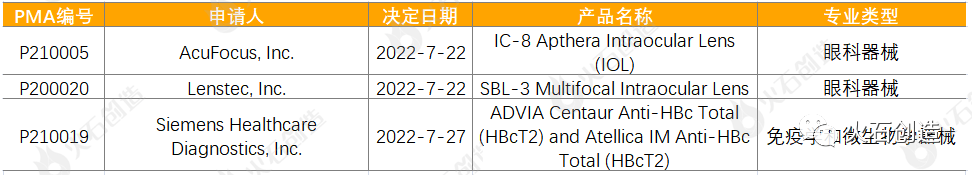
来源:美国食品药品监督管理局
(二)境内批准情况
截至2022年8月5日,2022年7月国家局公示了6个三类医疗器械进入创新审批绿色通道,见表5。
表5:2022年7月进入绿色通道的三类创新器械

来源:国家医疗器械审评中心
截至2022年8月5日,2022年7月国家局公示了5个三类创新器械获批上市,见表6。
表6:2022年7月获批上市的三类创新器械
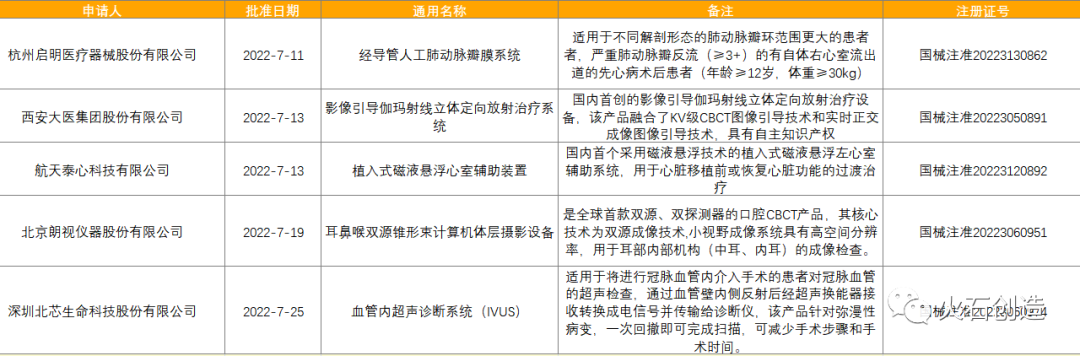
来源:国家医疗器械审评中心
截至2022年8月5日,2022年7月国家局共批准首次注册三类医疗器械产品174个,其中国产152个,进口22个。各省级药品监管部门7月共批准国产第二类医疗器械注册1234个,一类备案医疗器械920个。
统计数据显示,体外诊断试剂数量最多,共813项,占33.53%,基本上均为国产,为803项。除体外诊断试剂,批准注册类别数量排前三位的分别为注输、护理和防护器械,临床检验器械和无源手术器械。
表7:2022年7月国产、进口医疗器械批准注册类别数目分布情况
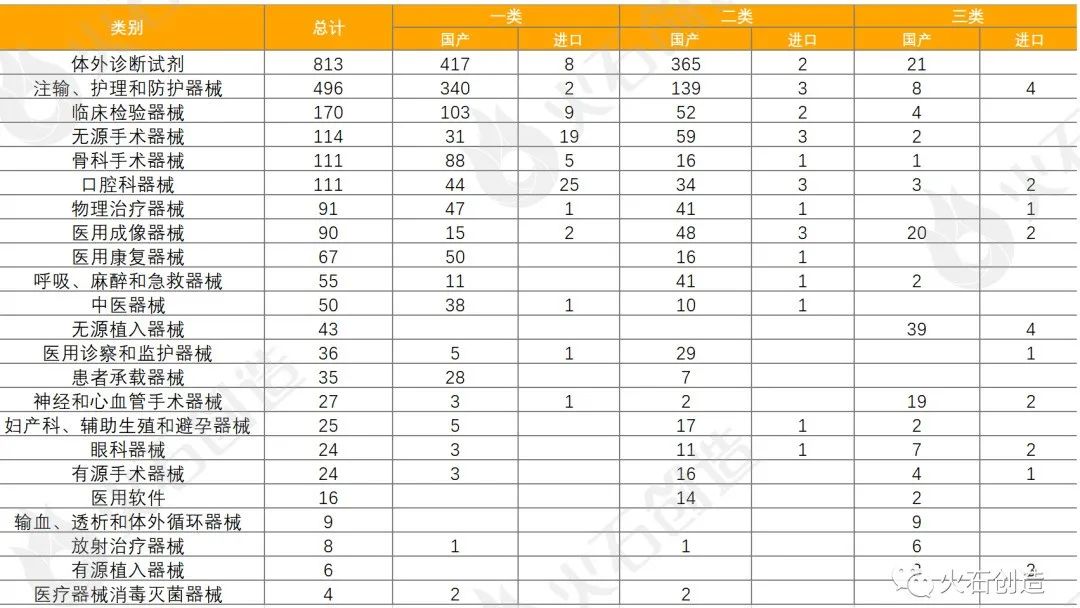
来源:国家医疗器械审评中心
从地域分布上,2022年7月国产二、三类注册产品批件最多的依次为湖南省(514件)、广东省(365件)、江苏省(222件)三个区域,见图5。
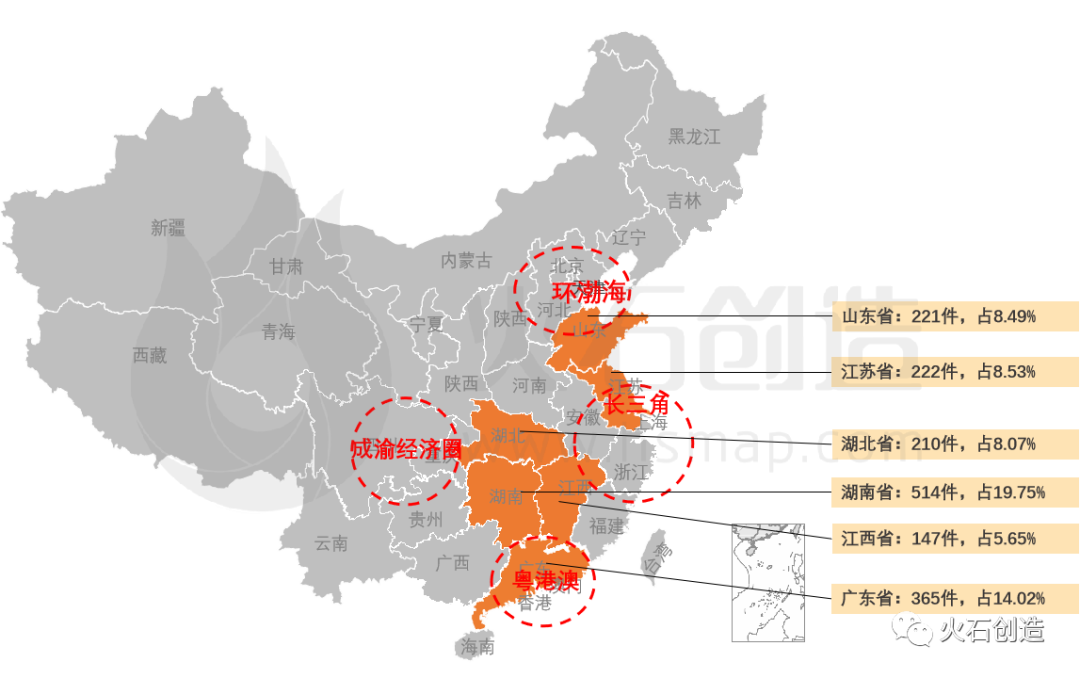
图5:国产获批器械区域分布
来源:火石创造产业数据中心

 CPhI制药在线
CPhI制药在线
 2018.07.24
2018.07.24
 49668
49668

 艾美仕
艾美仕
 2018.07.09
2018.07.09
 34702
34702


 2014.03.11
2014.03.11
 31117
31117