 会员动态
会员动态
 医药观澜
医药观澜
 2022.09.23
2022.09.23
 2665
2665
9月21日,中国药物临床试验登记与信息公示平台公示,复星医药控股子公司复星医药产业启动了一项癌症疫苗SurVaxM联合替莫唑胺辅助治疗初诊的胶质母细胞瘤的国际多中心(含中国)2期临床试验。SurVaxM是MimiVax公司开发的一种新型肿瘤免疫治疗产品,为一款多肽疫苗。复星医药产业于2019年通过一项近1.48亿美元的授权合作,获得该产品在中国的独家临床开发和商业化权利。
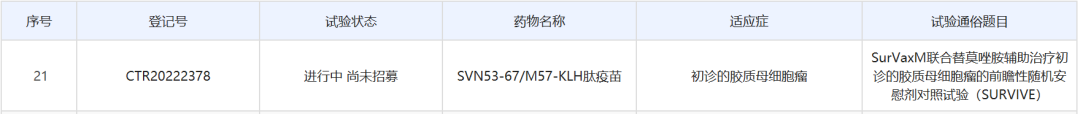
截图来源:中国药物临床试验登记与信息公示平台
公开资料显示,SurVaxM(SVN53-67/M57-KLH肽疫苗)是MimiVax公司开发的一种新型肿瘤免疫治疗产品,其可识别表达survivin蛋白的肿瘤细胞,并通过刺激患者自身的免疫反应控制肿瘤的生长和复发。Survivin蛋白与细胞生存相关,它在正常成人组织中极少能够检测到,但却在超过95%的胶质母细胞瘤及肝癌等多种肿瘤中有表达。
2019年11月,复星医药产业与MimiVax公司达成授权合作,在中国大陆、香港及澳门地区独家临床开发和商业化SurVaxM,授权的适应症为胶质母细胞瘤以及其他肿瘤和非肿瘤疾病。根据双方签订的《许可协议》,复星医药产业将向MimiVax公司支付1000万美元的首付款,至多2800万美元临床开发里程碑付款,以及产品商业化后至多1.1亿美元销售里程碑付款和一定比例销售提成。
此次复星医药产业启动的是一项SurVaxM联合替莫唑胺辅助治疗初诊的胶质母细胞瘤的前瞻性、随机、安慰剂对照试验(SURVIVE),主要研究者为首都医科大学附属北京天坛医院李文斌博士。该试验主要目的是比较两个治疗组中初诊胶质母细胞瘤患者的总生存期(OS),次要目的是比较两个治疗组患者的无进展生存期、在预设时间点的治疗相关总生存期和治疗相关无进展生存期等。
此前,SurVaxM治疗胶质母细胞瘤的2期研究结果曾登上2019年美国临床肿瘤学会(ASCO)年会。试验数据显示,该免疫疗法在胶质母细胞瘤中产生了令人鼓舞的疗效和免疫原性,并且毒性较低。根据今年2月MimiVax公司发布的新闻稿,对63名新诊断的胶质母细胞瘤患者进行的一项单臂2期研究表明,接受SurVaxM治疗的患者生存时间显著延长,诊断后一年有93.7%的患者存活,而根据历史研究预期的存活率为65%。
胶质母细胞瘤是一种高度致命的脑癌类型,它的侵袭能力异常强大,而目前仍然没有有效阻止其进展的方法。这些肿瘤细胞对已有的治疗方法都高度抵抗,因此患者的预期寿命在过去一段时间里基本没有明显提升。患者经常在初始治疗后一年内复发,接受标准治疗的患者中位生存期为16个月。
根据ClinicalTrials网站,目前SurVaxM正在海外开展多项临床试验,包括:联合替莫唑胺一线治疗新诊断胶质母细胞瘤的2期研究、联合PD-1抑制剂pembrolizumab治疗复发胶质母细胞瘤的2期研究、治疗接受来那度胺维持治疗的多发性骨髓瘤患者的1期研究、治疗转移性神经内分泌肿瘤(NETs)的1期研究等。
希望SurVaxM在临床研究中进展顺利,早日为胶质母细胞瘤等肿瘤患者带来新的治疗选择。
参考资料:
[1] 中国药物临床试验登记与信息公示平台.Retrieved Sep 21,2022, from http://www.chinadrugtrials.org.cn/clinicaltrials.searchlistdetail.dhtml
[2] 上海复星医药(集团)股份有限公司关于控股子公司签署许可协议的公告。Retrieved Nov 13,2019, from http://pdf.dfcfw.com/pdf/H2_AN201911131370701928_1.pdf
[3] Roswell Park Opens Phase 2B Randomized Clinical Trial of Promising Brain Cancer Immunotherapy.Retrieved Feb 4,2022, from https://www.mimivax.com/roswell-park-opens-phase-2b-randomized-clinical-trial-of-promising-brain-cancer-immunotherapy/

 豪森药业
豪森药业
 2019.05.08
2019.05.08
 27562
27562

 蒲公英
蒲公英
 2018.07.10
2018.07.10
 15459
15459

 生物制药小编
生物制药小编
 2018.06.27
2018.06.27
 14907
14907