 研发追踪
研发追踪
 凯莱英药闻
凯莱英药闻
 2022.09.30
2022.09.30
 2765
2765
2022年9月26日,第一三共(“Daiichi Sankyo”)宣布,日本厚生劳动省(MHLW)已经批准了Ezharmia(valemetostat)的上市申请,这是全球第一个获得监管批准的EZH1/EZH2双重抑制剂,用于治疗复发或难治性成人 T 细胞白血病/淋巴瘤 (ATL)。ATL是一种罕见的侵袭性外周T细胞淋巴瘤(PTCL),在日本部分地区和其他地区发病率较高;近90%的患者在完成强化一线治疗后复发,此时几乎没有可用的选择。
关于关键 II 期研究
Ezharmia的获批是基于一项关键II 期研究的数据,该研究在复发或难治性ATL的日本患者中开展,用于评估valemetostat治疗复发或难治性ATL患者的有效性和安全性,这些患者既往接受过莫格利珠单抗或至少一次系统化疗治疗。
数据显示:valemetostat 在先前接受过治疗的患者中表现出 48% 的客观反应率;在 20% 的患者中观察到完全反应,在 28% 的患者中观察到部分反应。对于日本患有侵袭性 ATL 亚型的患者,中位总生存期长达 12 个月。
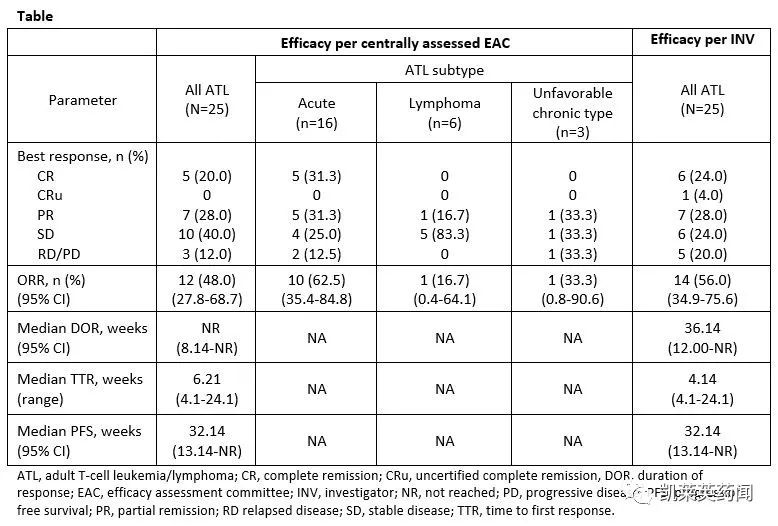
在安全性上,该药物耐受性良好,但 25 名患者中有 24 名出现治疗相关不良事件。最常见的包括血小板计数减少、贫血、味觉障碍(味觉障碍)和白细胞计数减少。
关于Ezharmia
Ezharmia是一种强效、选择性、小分子抑制剂,旨在通过靶向EZH1和EZH2对抗表观遗传失调。EZH2和EZH1可催化三甲基与组蛋白H3的第27位赖氨酸(H3K27me3)位点连接;H3K27me3是一种表观遗传标记,参与下调与肿瘤抑制和细胞分化相关的基因表达。临床前研究表明,与EZH2选择性抑制剂相比,valemetostat能强烈地抑制细胞中H3K27me3 。此前,valemetostat已获MHLW授予治疗ATL的孤儿药资格(ODD)及治疗PTCL的SAKIGAKE(创新药物)资格,以及FDA治疗PTCL的ODD。
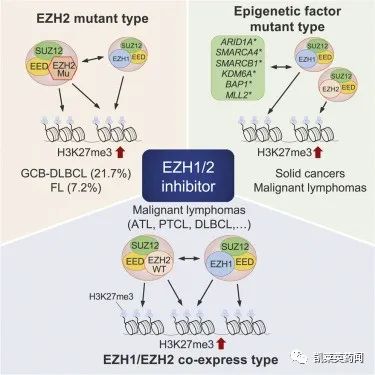
EZH即Zeste同源物增强子,是Polycomb蛋白家族PRC2复合体的催化酶,具有组蛋白甲基转移酶(HMTase),介导基因沉默。EZH1和EZH2作为同源基因,其中EZH1在非增殖性成体器官中的表达更为丰富,HMTase活性相对更弱;EZH2则与增殖密切相关,在干细胞和肿瘤细胞中表达较高。研究发现,在多种恶性肿瘤细胞中存在EZH2的突变及异常表达,与癌症的发生、发展、转移、侵袭及预后不良有重要关系。
第一三共并不是唯一一家致力于开发双 EZH1 和 EZH2 抑制剂的公司,除此以外还有辉瑞的PF-06821497,目前处于滤泡性淋巴瘤、小细胞肺癌和去势抵抗性前列腺癌的 I 期开发中;此外,海和也正在开发HH2853用于外周T细胞淋巴瘤、实体瘤等适应症。将部分处于临床以上阶段的EZH抑制剂统计如下:

关于PTCL和ATL
PTCL是一组高度异质性的淋巴瘤细胞异常恶性增殖性疾病,其发病率具有明显的地域差异。在中国,PTCL发病例数约占非霍奇金淋巴瘤的30%-40%,显著高于欧美国家的10%-15%。ATL由人类T细胞嗜淋巴细胞病毒 1 型(HTLV-1) 引起,全世界每年诊断出超过3,000例新的ATL病例。ATL 在 HTLV-1 病毒流行的地区发生频率更高,包括日本西南部、中南美洲和澳大利亚中部;其中,在日本每年约有 1,000 例新的 ATL 病例和超过1,000 例 ATL 死亡。在北美和欧洲也观察到病例,非流行地区的 ATL 发病率正在上升。ATL的治疗基于亚型,主要包括强化多药化疗方案。在世界范围内存在大量未满足的临床需求。
英文原文:https://www.daiichisankyo.com/files/news/pressrelease/pdf/202209/20220926_E.pdf

 新浪医药
新浪医药
 2018.07.12
2018.07.12
 34307
34307

 医药地理
医药地理
 2018.10.22
2018.10.22
 18806
18806

 医谷
医谷
 2019.03.18
2019.03.18
 18732
18732