 会员动态
会员动态
 医药观澜
医药观澜
 2022.11.16
2022.11.16
 1342
1342
今日(11月15日),中国国家药监局药品审评中心(CDE)官网公示,恒瑞医药的马来酸吡咯替尼片的新适应症上市申请拟被纳入优先审评,拟用于治疗HER2阳性、晚期阶段未接受过抗HER2治疗的复发或转移性乳腺癌患者,即一线治疗HER2阳性复发/转移性乳腺癌患者。
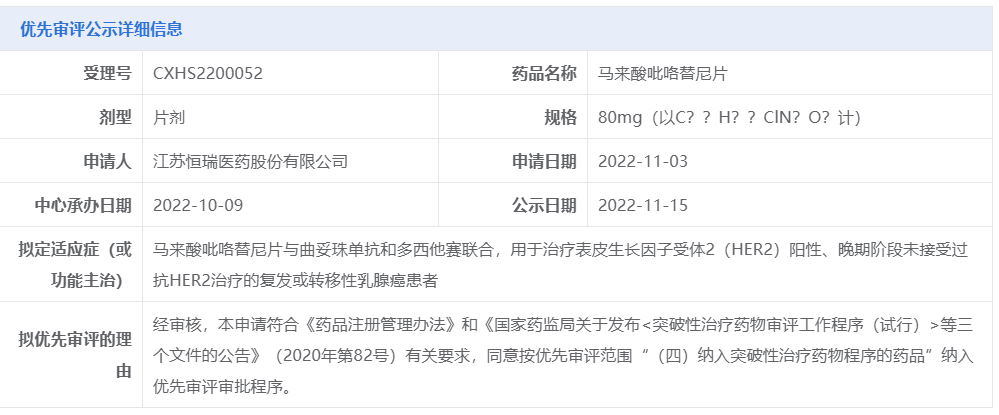
截图来源:CDE官网
马来酸吡咯替尼片是恒瑞医药自主研发的一款口服HER1/HER2/HER4酪氨酸激酶抑制剂。作为一种小分子、不可逆、泛ErbB受体酪氨酸激酶抑制剂,吡咯替尼通过阻止肿瘤细胞内表皮生长因子(EGFR)和人表皮生长因子受体2(HER2)的同质和异质二聚体形成,抑制其自身的磷酸化,阻断下游信号通路的激活,从而抑制肿瘤细胞生长。
2018年,吡咯替尼凭借2期临床研究数据获中国国家药监局(NMPA)附条件批准上市。2020年,吡咯替尼凭借两项3期研究(PHENIX、PHOEBE)结果获得NMPA完全批准上市,联合卡培他滨用于HER2阳性、接受过曲妥珠单抗的复发或转移性乳腺癌患者的治疗。2022年5月,吡咯替尼获批第二个适应症,与曲妥珠单抗和多西他赛联合用于HER2阳性早期或局部晚期乳腺癌患者的新辅助治疗。
吡咯替尼本次拟被纳入优先审评的上市申请针对的是一项新适应症:马来酸吡咯替尼片与曲妥珠单抗和多西他赛联合,用于治疗表皮生长因子受体2(HER2)阳性、晚期阶段未接受过抗HER2治疗的复发或转移性乳腺癌患者。
2022年8月,恒瑞医药宣布吡咯替尼联合曲妥珠单抗和多西他赛在一线治疗HER2阳性复发/转移性乳腺癌的3期临床中达到主要终点。这是一项名字为HR-BLTN-III-MBC-C的随机、双盲、平行对照、多中心的3期临床试验,旨在评价吡咯替尼联合曲妥珠单抗和多西他赛一线治疗HER2阳性复发/转移性乳腺癌的疗效和安全性,对照组为安慰剂联合曲妥珠单抗和多西他赛。该研究由中国医学科学院肿瘤医院徐兵河院士担任主要研究者,全国40家中心共同参与。该试验共入组590例受试者。试验主要研究终点是研究者评估的无进展生存期(PFS),次要研究终点包括独立影像评估委员会(IRC)评估的PFS、总生存期(OS)、总缓解率(ORR)、临床获益率(CBR)、客观缓解持续时间(DOR)和安全性。
根据恒瑞医药新闻稿,在开展方案预设的期中分析时,由独立数据监查委员会(IDMC)判定主要研究终点PFS达到方案预设的优效标准。试验数据显示,对于复发/转移阶段未接受过任何系统抗肿瘤治疗的HER2阳性乳腺癌患者,与安慰剂联合曲妥珠单抗和多西他赛治疗相比,吡咯替尼联合曲妥珠单抗和多西他赛治疗可显著延长患者的PFS。
根据2020年世界卫生组织国际癌症研究机构(IARC)发布的数据,乳腺癌已成为全球第一大恶性肿瘤,是女性最常见的恶性肿瘤之一。2020年中国癌症数据显示,乳腺癌发病率占全身各种恶性肿瘤发病率的9.1%。目前中国乳腺癌发病率增长迅速,并且近50%患者治疗后会出现复发和转移。而HER2阳性乳腺癌约占了全部乳腺癌的20%-25%。
希望恒瑞医药马来酸吡咯替尼片的新适应症上市申请早日获批,为患者带来新的治疗选择。

 豪森药业
豪森药业
 2019.05.08
2019.05.08
 27591
27591

 蒲公英
蒲公英
 2018.07.10
2018.07.10
 15482
15482

 生物制药小编
生物制药小编
 2018.06.27
2018.06.27
 14936
14936