 会员动态
会员动态
 研发客
研发客
 2022.12.27
2022.12.27
 2182
2182
编者按
泽布替尼与伊布替尼的头对头ALPINE研究,经独立评审委员会(IRC)确认,取得24个月无进展生存率(PFS)优效性结果(79.5%vs67.3%),该试验入选今年美国血液学会(ASH)年会突破摘要口头报告,并同时刊载于《新英格兰医学杂志》,这是百济神州研发的又一重要时刻。
这些成果的背后,是一批英勇无畏的国际化探路者。他们身先士卒探索国际市场,积极与发达市场监管机构建立沟通,开拓创新启动临床研发新模式,以此逐步树立百济神州创新药研发的国际口碑。
如今百济神州血液瘤研发管线已攻下 BTK抑制剂Best in Class这一城,那么,下一个目标会在哪里,泽布替尼的开发过程又有哪些经验值得借鉴?本文特别专访了百济神州副总裁、中国血液肿瘤临床开发负责人郭海宜。
在百济神州,郭海宜先后领导了BTK抑制剂泽布替尼、Bcl-2抑制剂BGB-11417等产品的多个临床开发项目,见证并参与了百济神州创新药的国际化历程。在她看来,国际化只是新药研发的起点而不是终点,其真正目的是为全球患者带来可及可负担的好药。
为此,每个产品在研发布局之初,就要有国际化的研发视野和研发格局,需要始终秉承“患者为先,科学为本”的研究理念。“创新药开发不用给自己设限,事实证明没有山峰不可攀越,所以我感觉离开外企加入百济神州,与团队成员并肩作战的这五年‘很值’。”她说。

郭海宜 百济神州副总裁、中国血液肿瘤临床开发负责人
百济神州创始人王晓东院士曾说过,不用提前想我们能做成什么,只要想我们需要做什么,如何做是正确的。郭海宜说在这个理念的指引下,过去五年泽布替尼不断斩获里程碑事件:
成功敲开美国食品药品监督管理局(FDA)大门;首个BTK抑制剂在慢性淋巴细胞白血病(CLL)中头对头打败伊布替尼;今年以来临床数据接连刊登于《柳叶刀》、《临床肿瘤杂志》、《新英格兰杂志》等国际权威顶刊,获得美国国立综合癌症网络(NCCN)指南最高级别用药推荐;已在60多个国家和地区获批上市。

ALPINE研究结果在《新英格兰医学杂志》发表。
郭海宜介绍说,随着泽布替尼全球影响力不断提升,百济神州正继续扩大血液瘤药物研发管线的覆盖版图,并将泽布替尼探索形成的研发经验,应用于血液肿瘤领域新产品的高效开发。
一颗棋子扩展出两盘大棋
白血病及骨髓瘤临床阶段产品推出,是百济神州血液瘤研发管线近期出现的明显变化。公司的血液瘤产品研发正从聚焦于淋巴瘤的相对单一状态逐步分化为含两套完整的适应症体系的多元化产品管线:一套管线针对B细胞淋巴瘤,以泽布替尼为核心;另一套管线针对髓系血液疾病(AML/MDS,多发性骨髓瘤),研发围绕新一代BCL-2抑制剂BGB-11417展开。
血液瘤管线已储备了丰富的创新治疗药物,两个核心产品周围围绕众多研发新星,包括多个“首创”靶点抗体,如HPK1抑制剂BGB-15025、TIM3抑制剂BGB-A425等,以及多款当下热门的新类别治疗药物。

郭海宜特别提到,百济神州原有侧重淋巴瘤治疗的管线布局将逐步拓展,新药研发会完整覆盖血液肿瘤三大领域。同时,种类齐全的管线产品布局,为探索不同组合的新型治疗方案提供更多可能,也将为患者探索出更多样化的治疗选择。
BGB-11417即展现出这样的开发策略。
该产品现已针对慢性淋巴细胞白血病(CLL)、非霍奇金淋巴瘤(NHL)、急性髓细胞白血病(AML)、骨髓增生异常综合征(MDS)和多发性骨髓瘤(MM)等适应症,开展了广泛探索性研究。研究中还根据疾病特点,适时加入泽布替尼、阿扎胞苷等药物,探索联合用药的治疗效果。
“针对不同适应症,我们血液肿瘤临床开发团队在临床试验设计中,会仔细考量适应症的优先级布局、临床研发策略和计划制定,以及临床试验的设计等重要事项。具体到哪些适应症可以联合开发、更高效地覆盖适应症探索,哪些适应症需要单独探索、有的放矢精准评估;另外还要确定目标人群、合适的治疗方案包括药物选择和剂量组划分、每个剂量组的入组病人数及采用的评价指标及评价标准等。这些事项都包含了大量的细节工作。”郭海宜说。
“掌控这两个系列产品的临床开发,就像在运筹帷幄两盘大棋。不同疾病可能对药物产生不一样的反应,不同用药组合也可能出现意料之外的治疗效果,我们要事先对药物和疾病充分了解,最终的决策可能一招制胜,但也可能一步错步步错。”
从BGB-11417公布的数据看,百济神州在新系列产品开发上旗开得胜。今年ASH年会上BGB-11417有多项临床研究数据对外公布,其中BGB-11417单药治疗或与泽布替尼联合治疗用于CLL/小淋巴细胞淋巴瘤(SLL)患者的Ⅰ期临床研究,入选ASH口头报告。
结果显示BGB-11417安全性良好,在79例参与研究的患者中,仅出现一例实验室检测的肿瘤溶解综合征(TLS),未发生临床TLS。另外,研究数据反映出BGB-11417具备较好的治疗潜力,在随访时间较长的两组复发难治CLL/SLL患者中,不论是单药治疗还是与泽布替尼联合用药,均有30%患者出现疾病完全缓解(CR)。
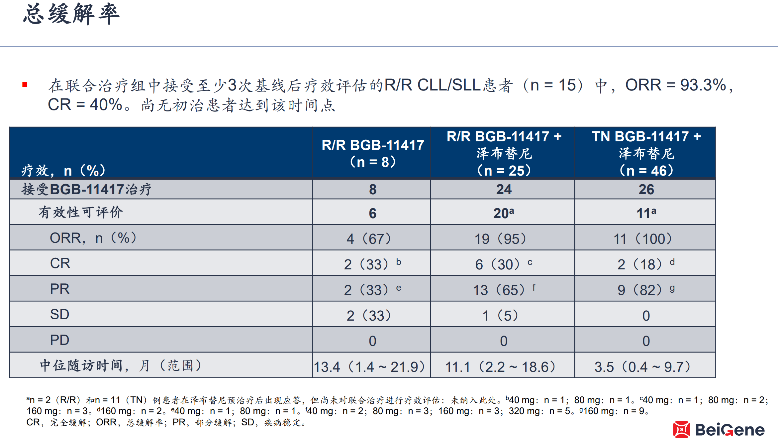
对于BGB-11417的开发,也将借鉴泽布替尼的开发经验。百济神州高级副总裁、全球研发负责人汪来博士在近日回答投资人提问时表示,将首先推进BGB-11417在复发难治套细胞淋巴瘤(r/r MCL)适应症的II期临床研究,国外同靶点竞品维奈克拉也尚未在该适应症上获得监管批准,BGB-11417因此有望以单臂研究结果向全球多个药品注册监管部门递交产品上市申请。
这样的针对临床需求以临床价值为导向的快速研究注册计划,百济神州已有过成功的经验。
泽布替尼首个注册研究也在MCL上开展,虽然伊布替尼当时已获批MCL适应症,但MCL患者多为老年患者,中位年龄达到70岁左右,伊布替尼的心脏毒性带来了临床用药的顾虑,且MCL患者接受伊布替尼治疗的CR比例仅约20%,中位无进展生存期刚过1年。这些都提示了巨大的未满足的临床需求。
而泽布替尼的Ⅱ期单臂注册研究结果显示,这是一个可以填补这个临床需求的新型BTK抑制剂,其CR率达77.9%,中位无进展生存期(PFS)33.0个月,并有更好的安全性表现。卓越的疗效和安全性的表现使得泽布替尼顺利获得美国市场的入场券。
由于团队在产品研发上积累了大量经验,百济神州管线布局已在向更前沿方向推进,近期不断推出的新型药物研发技术平台,包括通用细胞疗法CAR-NK、抗体偶联药物(ADC)以及靶向蛋白降解剂(PROTAC)等,也成为血液瘤管线涌现出的新特色。未来它们在满足临床需求、提升患者治疗结局方面,可能发挥重要作用。
BTK-CDAC产品就被公司寄予厚望,其是PROTAC平台研发的首个产品,其作用靶点与泽布替尼相同,但靶向蛋白降解剂起效不受酶活性或结合位点限制,有望克服泽布替尼治疗后C481S位点突变引起的耐药。目前BTK-CDAC正在开展Ⅰ期临床研究,初期数据已经显示出很好的信号。
郭海宜说:“目前公司的产品临床开发正全面加速,过去平均一年可能只有1~2个产品推进到临床研究阶段,但在不久的未来这个数量将提升到10个甚至更多。”
不以“阳性”结果论英雄
至于新产品能否续写泽布替尼的辉煌,郭海宜认为坚持“患者为先,科学为本”的临床设计理念,是实现目标的不二法则。她强调这与国家药监局药品审评中心(CDE)发布的《以临床价值为导向的抗肿瘤药物临床研发指导原则》理念是相一致的,国内外药品监管部门也都遵循相似的规则。
“临床试验取得阳性结果,不应该是运气使然或是玩数字游戏。我对于百济神州的临床试验设计印象最深刻的就在它对‘以人为本’的坚持。”郭海宜提到,临床试验设计以患者为中心、以科学为导向,包括深入了解患者特点,清晰定义入组人群,将患者利益置于优先位置,同时要考虑科学性。
对于国际多中心临床研究,还需要特别关注不同国家在法规要求、临床实践以及患者理念方面存在的差异。
郭海宜在此分享了国际多中心临床研究成功的关键经验——要在研究启动前对目标国家情况进行充分调研。包括研究入组患者时,当地法规对本国患者比例或种族组成的要求;临床实践差异是否导致病人基线水平差异,进而影响人群对试验药物的反应;另外文化、经济等因素也可能导致患者理念差异,例如血液瘤病人治疗中输血或骨髓移植的实践等。
“只有对这些差异因素深入了解,才能制定出准确的患者画像和合适的试验设计。”郭海宜说。
在泽布替尼与伊布替尼开展头对头比较的ASPEN、ALPINE研究设计中,团队曾就入组患者的画像反复讨论。特别是具有不同疾病不良预后因素的患者,在研究中如何分组如何控制其对于研究结果的影响,经常是需要反复推敲的话题。
在ALPINE研究中,伴有del(17p)/TP53突变等不良预后因素的CLL/SLL患者,也被一并纳入随机分组。根据历史数据,这类患者在接受多种BTK抑制剂治疗时,均有较好的应答率。
而ASPEN研究没有将MYD88/CXCR4野生型华氏巨球蛋白血症(WM)患者纳入随机分组范围,而是将他们单独组成队列仅接受泽布替尼治疗。早期研究数据显示,MYD88/CXCR4野生型WM患者,接受伊布替尼治疗后的VGPR/CR比例为0,但泽布替尼早期数据提示,其对MYD88/CXCR4野生型和突变型的WM患者,都显示了较好的治疗效果。
最终ASPEN研究中,泽布替尼显示出更好的疗效更深的疾病缓解及安全性趋势,但在研究终点指标CR和VGPR上未显示出统计学差异,这一结果多少给人留下遗憾。
“基于既往的研究数据,如果在ASPEN研究中将MYD88/CXCR4野生型患者也纳入随机分组,泽布替尼有更大可能获得优效性结果。”但郭海宜说,考虑到患者的最大获益,百济神州没有这样决策。“临床研究设计首先要考虑治疗的临床价值和患者利益,而不是单纯追求阳性的试验结果。即使这可能增加研究显示统计学差异的难度,百济神州团队仍然坚持了对于患者利益的选择。”
对于科学的坚持,使得ASPEN在科学的设计下精准地选择了对的患者,显示出了泽布替尼良好的治疗结果,而这一结果最终也让WM新适应症申请获得全球包括FDA在内的多个监管机构的批准。迄今为止,全球超过60多个国家和地区的市场,都已向泽布替尼敞开大门。
“我们在研究设计时,已对患者的基线情况及其他影响因素充分考虑,因此头对头比较的结果就是源于药物疗效的优劣,而不是两组人群差异导致的,这样的结果非常令人信服。”郭海宜说,“未来新产品的临床研究方案设计也会坚持践行百济神州的患者为先,科学为本的理念,从而争取更多国内外研究者、患者以及监管机构对产品研发的支持。”
让临床研究覆盖发展中地区和人群
作为新药临床开发的舵手,血液肿瘤临床开发团队随着大量早期阶段产品涌现,他们肩上的担子也更重了。百济神州仍在拓展研究边界,制定了临床研究“一带一路”策略,尽可能多地与国内偏远地区或缺乏经验的临床研究机构,以及发展中国家的研究机构合作,让药物研发惠及更多患者。
这样的研究也对临床开发团队提出更高的要求,尤其在方案设计时,要设身处地从研究者角度出发,保证方案的可操作性。
“为了让不同层级和水平的研究参与者都能顺利完成临床试验,方案设计要做到既详尽又通俗易懂,且不违背日常医疗操作常规,这样才能尽量避免在实操中出现方案违背,从而更好保证病人安全和数据质量。”
郭海宜举了一个例子:受试者在研究中可能对试验药物出现不同的反应,此时研究者只要查阅方案,就应能清楚了解下一步要如何行动,例如是否应降低用药剂量或停药。“要尽量做到申办方人员不在场的情况下,研究者也能随时随地从研究方案中获得大部分答案。”
“我同时也要求临床开发团队的成员对方案了如指掌,因为医学监察员是试验方案的作者也是第一责任人。”郭海宜说,关键项目的研究启动会,团队都会与负责临床运营的同事一起做好方案的介绍和解读,并解答研究者的困惑,保证研究人员都能对方案有准确的理解。不论在国内还是国外的研究中心,他们都采用相似的流程。
那些彼时初尝新药临床研究的机构,如今也实现了与百济神州共同成长。泽布替尼在美国递交上市申请时,美国FDA要求核查的两家中心分别是北京大学肿瘤医院和河南省肿瘤医院。

2019年10月,郭海宜带领团队在北京大学肿瘤医院为迎接FDA核查准备材料。
这两家医院都很有代表性,结果FDA对两家研究中心的核查都给出了“Perfect”的评价。即使是跨国制药公司,因为核查时的小瑕疵而收到FDA的483警告信的情况并不罕见。对这两家中国研究中心的核查,FDA严格而细致,但并没有从中发现问题。中国研究者对待研究的认真态度,以及研究质量获得了FDA的高度认可。

2019年10月,FDA核查圆满结束后,郭海宜携百济神州团队代表同河南省肿瘤医院研究者及院方合作伙伴合影。
郭海宜回忆起那时的感受,大家对核查感到既紧张又兴奋。“我接到FDA核查通知时还在澳洲出差,立马就订好机票直飞美国。心情就像读书多年要大考了,内心很忐忑,但想着马上要翻牌出结果了,心情还是很激动。我知道与百济神州血液瘤临床开发团队并肩作战,没有什么事是办不成的,大家一直处于亢奋的状态,把工作当成一份伟大的事业全力以赴。”

2019年9月,在美国加州圣马特奥支持FDA检查的百济神州中国团队合影。
FDA核查结束是一个中秋节的晚上,团队成员深夜结束工作后决定一起到酒店楼下的篝火堆旁赏月加庆祝,虽然当时篝火没有燃起,但郭海宜记得同事们聊工作感悟时兴奋而热烈的氛围。“知之者不如好之者,好之者不如乐之者。何谓乐之者?这群百济小伙伴就是最好的答案。”郭海宜说。
“就像我们给患者精准画像保证合理试验设计一样,我们团队也有自己的画像:
他们是亚瑟王与圆桌骑士,平等、有爱、各携所长;他们是逢山开路的射雕英雄,勇敢、坚毅、永葆初心。”

 豪森药业
豪森药业
 2019.05.08
2019.05.08
 27605
27605

 蒲公英
蒲公英
 2018.07.10
2018.07.10
 15492
15492

 生物制药小编
生物制药小编
 2018.06.27
2018.06.27
 14947
14947