 产业资讯
产业资讯
 药怪站住
药怪站住
 2023.03.22
2023.03.22
 1493
1493
2022年12.13日,武田与Nibmbus 就TYK-2变构抑制剂-TAK-279达成一笔总金额60亿美元的合作(首付款40亿美元)。武田在消化免疫占据一席之地,本次收购是进军皮肤免疫的重要一步。今年AAD(美国皮肤病学会)释放了IIb期数据,一睹为快。
从作用机制上讲,靶点TYK2主要介导I型干扰素、IL-12和IL-23三条通路,这三条通路在银屑病的发生发展中扮演重要角色,尤其是以IL-23-Th17轴为重,目前所有高效的靶向药都是作用于这条通路的上下游,发挥快速/深度清除皮损的作用。
去年BMS开发的全球首款TYK2-变构抑制剂-Deucravacitinib凭借两项Global大III期(PSO-1和PSO-2)在美国上市,用于治疗中重度斑块状成年银屑病患者。Deucravacitinib集Deno的氘代(改善代谢稳定性、减少毒性代谢物)和变构抑制于一身,实现靶向TYK-2的高选择性。体外研究显示,Deucravacitinib对TYK2选择性是JAK1和JAK3的100倍以上,是JAK2的3000倍以上。在研适应症包括但不限于:PsA和SLE都处于Global III期。前文中提过的TYK2的另一种研发思路(辉瑞思路),JAK1/TYK2双靶竞争性抑制剂,皮肌炎适应症处于Global III期。
Nimbus的TYK-2变构抑制剂-TAK-279开发走的是BMS思路,可以说是deucravacitinib fast follow下的产物,而且号称“Best in class”。从体外数据看,相比deucravacitinib,TAK-279在TYK2-JH2和JAK1-JH2之间形成了更好的选择性,Kd值分别为0.034 nM和5000 nM。
、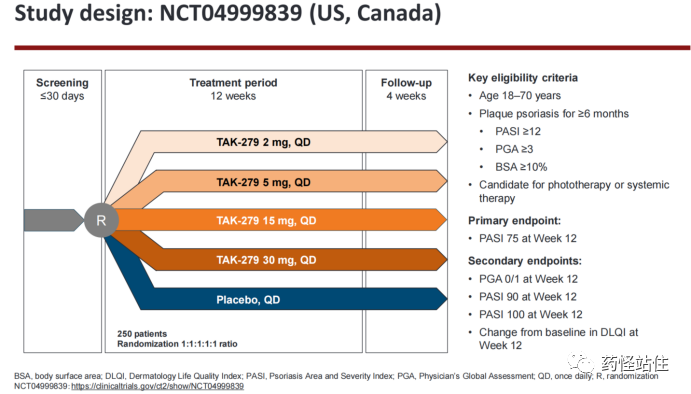
这是一项随机、安慰剂对照、按照1:1:1:1:1分配至不同剂量组和安慰剂组,探索相比安慰剂,不同剂量TAK-279用于适合接受光疗和系统性治疗的稳定性中重度斑块状银屑病患者的疗效和安全性,主要终点为PASI75@12周。设计与BMS Deucravacticinib的II期IM011-011几乎如出一辙。
、
患者基线在几个代表银屑病严重程度的指标上,PASI评分、PGA评分、BSA均值、DLQI评分与IM011-011相近,但是这项II期既往接受过生物制剂的比例仅有15%,严重低于IM011-011的43%,又回头了确认下Nimbus的II期确实是在美国和加拿大做的,按道理来说欧美生物制剂应该更普遍,15%像个亚洲人群,还是非中国的亚洲人群,我们知道,既往经生物制剂治疗可能代表更重的、更难治的人群,很难不怀疑研究人群经过挑选,但考虑到本研究的起始时间(2021.08.18-2022.08.19)处于全球新冠大流行期间,可能对于需要定期打针的生物制剂来说,依从性降了下来,也是一种可能的原因。


研究主要终点显示,15 mg qd组PASI 75达67.9%@12周,PASI 90达45.3%@12周,PASI 100达15.1%@12周,相比之下,30 mg qd组PASI 100数值上更高32.7%@12周。
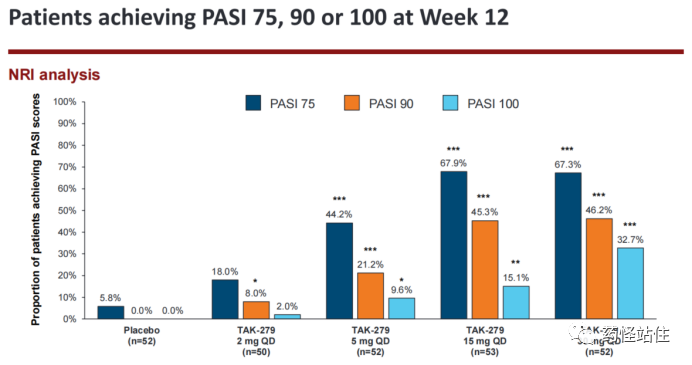
横向对比IM011-011,≥3 mg bid组PASI 75达66.7%-75%,PASI 90 达44%左右,PASI 100 25%左右,很难看出来疗效数据有多大差异。(非头对头研究,不建议进行跨研究比较)

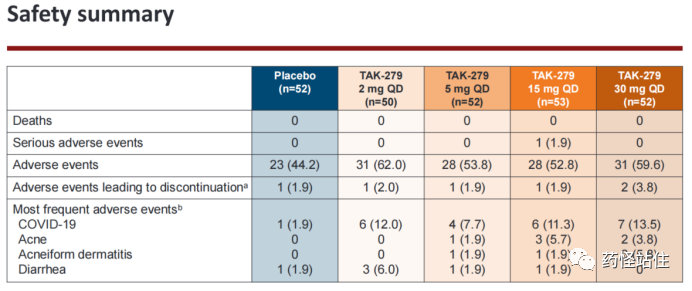
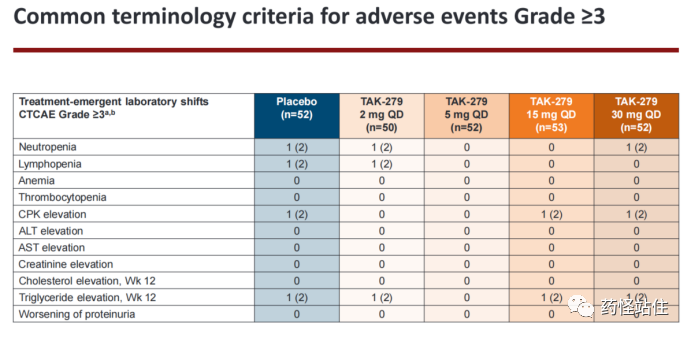
最后是本研究的安全性,没什么好说,TYK-2变构抑制剂主打的就是一个“安全”,在Deucravacitinib的基础上,再次印证这条通路不会产生传统JAK1-JAK3竞争性抑制剂的类似毒,不会对血液学、血脂学、血液生化产生有临床意义的变化,未来获批大概率不带黑框警告。
顺便看下TAK-279的临床开发计划,II期的有狼疮、IBD和PsA,抄BMS作业,唯一进到III期的是PSO(TrialTroveID-442219),情理之中,卵而研究还没开始,计划是2023.12.01开始,开句玩笑,真是这个进度表的话,恐怕国产TYK2变构抑制剂III期都做完了。
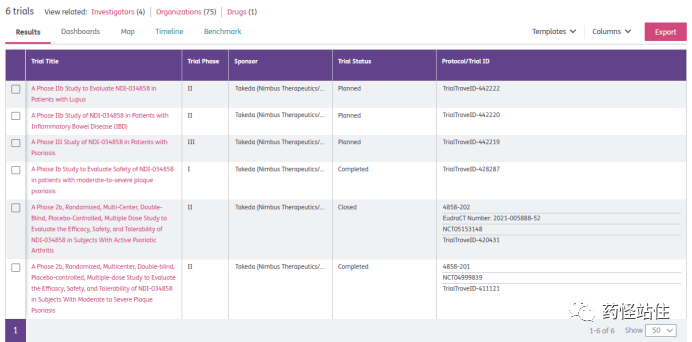
综上所述,至少根据这项IIb期数据看不出TAK-279有超越Deucravacitinib成为Best in Class的潜力,所以它真的值60亿美元吗?武田自有考虑,就像辉瑞430亿美元收购Seagen,用不着也轮不到我们考虑。

 CPhI制药在线
CPhI制药在线
 2018.07.24
2018.07.24
 49668
49668

 艾美仕
艾美仕
 2018.07.09
2018.07.09
 34702
34702


 2014.03.11
2014.03.11
 31116
31116