来源:药智网 2017-12-19
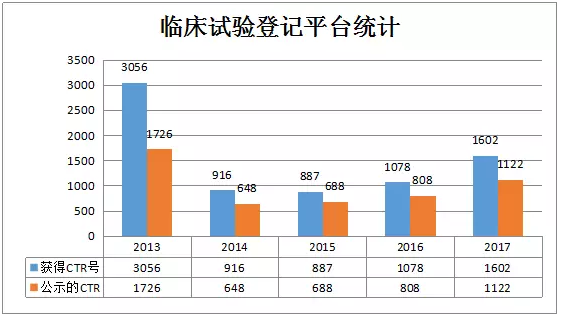
随着“药物临床试验数据自查核查”和“仿制药质量和疗效一致性评价”等政策的实施,临床试验的关注度不断提高。药物临床试验登记平台的数据也逐年增加,截止2017年12月15日,平台获得CTR号的临床试验总数为7553项,公示5020项。
平台历史背景
2012年11月1日,CDE发表新闻“药审中心网站开通《药物临床试验登记和信息公示平台》(试运行)”,首次向社会公告了平台项目并成为平台的诞生日。
2013年9月6日,CFDA发布了2013年第28号公告:“关于药物临床试验信息平台的公告”,强制要求凡获CFDA临床试验批件并在我国进行临床试验(含生物等效性试验、PK试验、I、Ⅱ、Ⅲ、Ⅳ期试验等)的,均应在平台进行登记与信息公示。公告中对登记时限等提出明确要求,例如:3年内未完成首次提交公示的,批件自行废止。
2013年11月25日,独立的“药物临床试验登记与信息公示平台”网站上线,同时试行版平台关闭。
2015年12月1日,化学药BE试验备案信息平台”模块在“药物临床试验登记与信息公示平台”网站上线运行。
2017年已公开的临床试验分析
2013年28号公告要求:获得药物临床试验批件的,申请人须在获批件后1个月内完成试验预登记,以获取试验唯一登记号。但是,部分药企获得登记号后并未完善和公示临床试验信息,所以笔者接下来仅对2017年12月15日前公示的1122项临床试验进行全面分析。
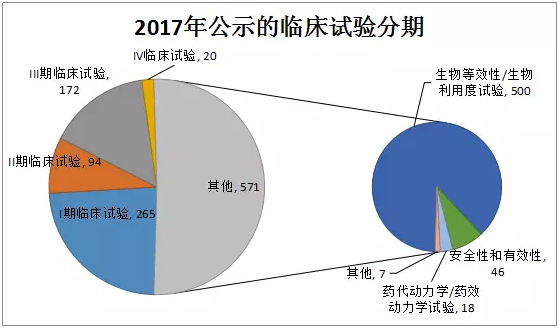
1、2017年临床试验分期
2017年临床试验分期中“其他”的占比急速上升,达到50%,这一数据在2016年仅为34%。究其原因是随着仿制药质量和疗效一致性评价的开展,生物等效性/生物利用度试验登记增加,对“其他”分期进行试验类型统计,生物等效性/生物利用度试验就有500个。
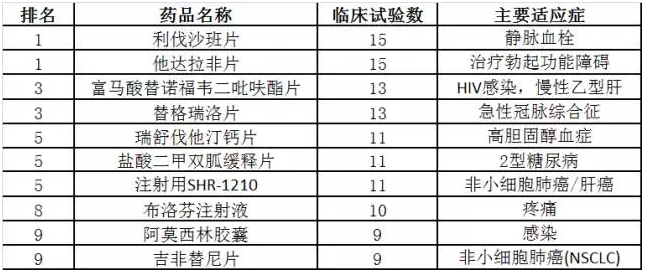
2、2017年临床试验最受关注的药品TOP10
对药品的临床试验登记情况统计发现,2017年最受关注的药品为利伐他班片和他达拉非片,其次是富马酸替诺福韦二吡呋酯片和替格瑞洛片。进一步分析统计发现,最受关注的药品TOP10基本都是开展的生物等效性试验。值得一提的是恒瑞医药的注射用SHR-1210主要开展的是1期、2期、3期临床试验,引领了新药临床试验。
注射用SHR-1210:本品是恒瑞医药自主研发的1类PD-1单抗,2015年1月19日进入CDE审评中心(受理号CXSL1400153),为重大专项产品;2016年2月6日获批临床批件。据报道2015年9月3日恒瑞以2500万美元首付款加总额可达7.7亿美元PD-1抗体SHR-1210海外(中国大陆、港澳台以外)权益出售给美国制药公司Incyte,成为中国企业第一次转让创新生物药品的里程碑事件。
表1:最受关注的临床试验药物TOP10
3、2017年临床试验登记最积极的企业
总的来说,2017年临床试验登记和各企业的整体实力呈正相关。正大天晴药业临床试验登记数量最多,其次是龙头企业恒瑞医药。不过正大天晴和恒瑞不同之处在于,正大天晴登记的临床绝大多数为生物等效性试验,而恒瑞医药则是以安全性和有效性试验居多。齐鲁、华海、海正、扬子江等药业也有较多的生物等效性试验,可见,2017仿制药质量和疗效一致性评价成为了各企业的重头戏。
表2、2017年临床试验登记最积极的企业

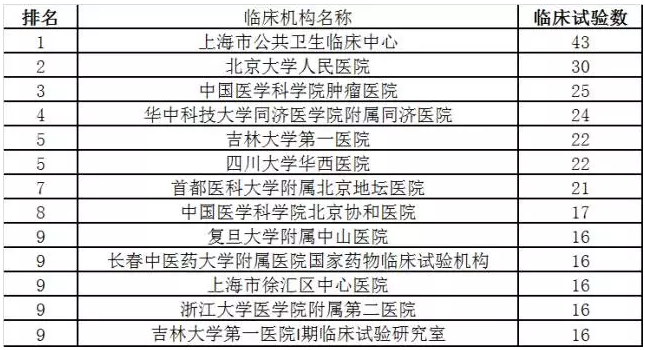
4、最忙碌的临床试验机构
最后简单看一下2017年最忙碌的临床试验机构,这里就不多做分析。
表3、2017年最忙碌的临床试验机构
综上所述:纵观2017年已登记临床试验,可以发现BE试验所占比重较大,恒瑞SHR-1210等重磅药品引领了新药临床试验,大型药企临床试验数量较多。本文数据来源于CDE药物临床试验登记与公示平台和药智中国临床试验数据库。