亚盛医药(Ascentage Pharma)是一家立足中国、面向全球的处于临床阶段的原创新药研发企业,致力于在
肿瘤、乙肝及与衰老相关疾病等治疗领域开发创新药物。近日,该公司宣布,其临床开发阶段1类新药Bcl-2抑制剂APG-2575日前接连获得美国食品和药物管理局(
FDA)2项
临床试验许可,将分别开展作为单药或联合治疗复发/难治慢性淋巴细胞
白血病(r/r CLL)/小淋巴细胞淋巴瘤 (r/r SLL)的Ib/II期研究;作为单药或联合治疗华氏巨球蛋白血症 (Waldenström Macroglobulinemia,WM)的Ib/II期研究。此外,APG-2575日前还在中国获得国家药品监督管理局(NMPA)药物审评中心 (CDE) 临床许可,将开展单药或联合治疗复发/难治性急性髓系白血病(r/r AML)的Ib期研究。
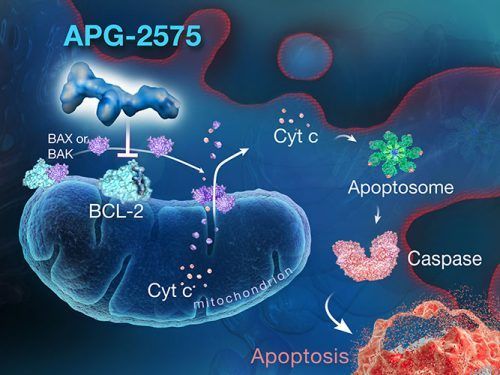
APG-2575是亚盛医药临床开发阶段的新型口服Bcl-2选择性小分子抑制剂,通过选择性抑制Bcl-2蛋白来恢复肿瘤细胞程序性死亡机制(
细胞凋亡),从而杀死肿瘤,拟用于治疗多种血液恶性肿瘤。以Bcl-2家族蛋白为靶点的药物研发多年来被证实是极其困难的,但2016年4月在美国成功上市的Bcl-2选择性抑制剂Venclexta为该靶点药物的开发提供了强有力的临床验证依据。APG-2575则是在全球层面继Venclexta之后罕有的进入临床开发阶段的Bcl-2选择性抑制剂。APG-2575去年在中国启动血液
肿瘤的I期临床研究,成为首个进入临床阶段的国产Bcl-2选择性抑制剂。
此前,APG-2575针对治疗血液肿瘤的I期
临床试验已在美国和澳大利亚启动,迄今未观察到任何剂量限制性毒性(DLT)以及Bcl-2抑制剂常见的
肿瘤溶解综合征(TLS),显示了APG-2575在
临床试验中的良好的安全性。正是基于APG-2575良好的临床前数据及早期临床数据,亚盛医药针对APG-2575在联合CD20 单抗、BTK抑制剂等药物治疗CLL/SLL、WM、AML的Ib/ II期研究接连获得中美两国药监部门的临床许可。
APG-2575单药或联合利妥昔单抗(rituximab)/acalabrutinib治疗复发难治CLL/SLL患者的Ib/II期研究:该项研究为全球多中心、开放性Ib/ II期剂量疗效探索研究,旨在评估APG-2575单药或者联合rituximab/acalabrutinib治疗复发难治CLL/SLL患者的安全性、耐受性,并初步评估有效性。
APG-2575单药或联合依鲁替尼(ibrutinib)/利妥昔单抗(rituximab)治疗WM患者的Ib/II期研究:该项研究为全球多中心、开放性Ib/ II期剂量疗效探索研究,旨在评估APG-2575单药或者联合依鲁替尼(ibrutinib)/利妥昔单抗(rituximab)治疗WM患者的安全性、耐受性、PK特征及初步的疗效观察。
APG-2575在中国单药或联合化疗治疗复发难治AML患者的Ib临床研究:该项研究为多中心、开放性Ib期剂量疗效探索研究,旨在评估APG-2575单药或者联合化疗治疗AML患者的安全性、药代动力学。
亚盛医药首席医学官翟一帆表示:“APG-2575是公司细胞凋亡产品管线的重要临床开发产品,是首个进入临床的国产Bcl-2选择性抑制剂。基于此前良好的临床前数据及早期临床数据,APG-2575接连获得中国CDE和美国FDA多项Ib/ II期临床试验许可,也正是我们全球化临床开发策略全面推进的体现。联合用药是肿瘤治疗未来发展趋势,希望我们的临床试验能更早、更快让复发难治的血液肿瘤患者受益。”