来源:Insight数据库 2017-1-3
受到2015年药品政策风云变幻的持续影响,2016年药品申报数量达到了低谷。据Insight-ChinaPharmaData数据库统计,2016年CDE共新承办药品申请3735个,远远低于前五年每年CDE承办的受理号数量。
注:本文统计数据来源Insight-ChinaPharmaData数据库,数量均按受理号计,数据统计截止日期为2016年12月27日,时间以CDE承办时间为准。
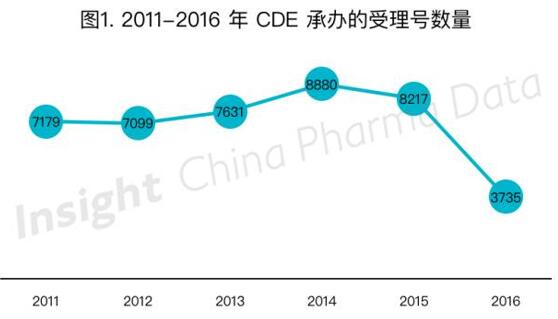
如图1所示,2011年以来,CDE新承办受理号数量在2014年达到顶峰,2015年出台了一系列解决药品积压受理的政策后,2015年下半年起承办数量就开始下降。2016年3月药品申报出现了一个小高峰,该月药品申报数量为506个,但仍明显低于2015年同期的719个,此后药品申报数量继续下降,每月受理量均低于300个(见图2)。该现象与今年4月一致性评价新政落地以及3月「化学药品注册分类工作改革方案」的正式出台有着密不可分的联系。
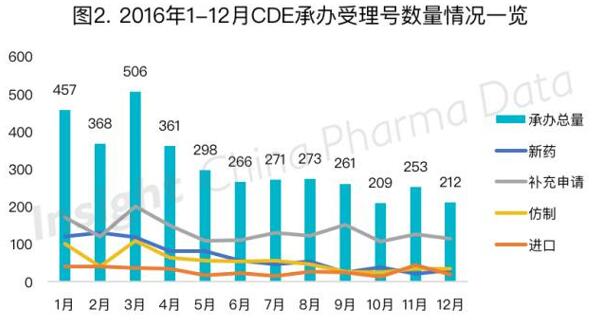
从具体申报的类别来看,新药申报受影响最大。从今年3月起,新药申报数量一直与仿制药不相上下,7月、11月仿制药申报数量多于新药申报数量,这一现象已有两年未见。而补充申请与进口药受到的影响则较小。
注:本文所统计的「新药」是指申请类型为「新药」的受理号,包括旧药物注册分类1-3类以及新1类,仿制药指申请类型为「仿制」的受理号,包括旧注册分类的4-6类及新注册分类的3-4,以便比较化学药品新注册分类实施之后,含义不同的新药和仿制药从数量上的变化情况。
下面我们分别看看化药、中药以及生物制品的申报受理情况。
一、化药申报量大幅跳水
化药一直是药物申报里的大头,今年化药申报持续缩水。总体来看,与2015年相比,化药新药、仿制药、进口药分别缩水75.8%,66.4%和49.5%,新药申报量缩水尤其明显。2016年全年化药新药申报量为658个,几乎与仿制药申报量638个持平,而前两年新药申报量均高于仿制药申报量。在化学药品新注册分类实施之后,原有3类药不能再伪装成「新药」,申请类型变为「仿制」,打破了概念上「新药」一直以来虚高于仿制药的局面。
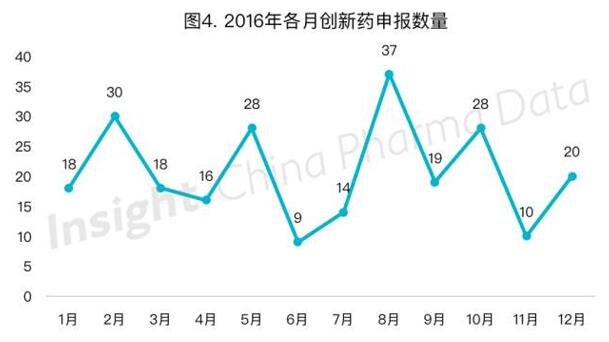
(一)1.1类化药逐渐退出历史舞台,1类新药上场
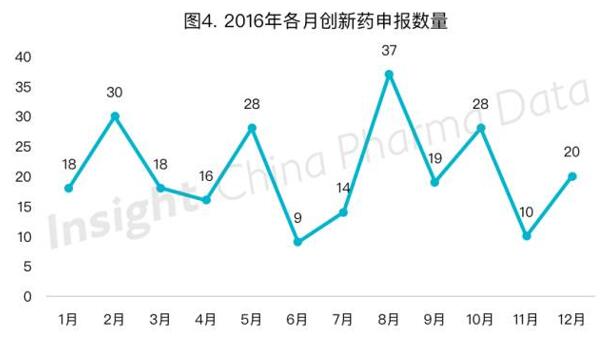
创新药(国内外均未上市的药品,旧注册分类1.1-1.6类及新注册分类1类)申报趋势呈现平稳的状态(图4)。而从具体注册分类上看,按旧1.1类申报的化药数量在2016年初有所动荡反复,5月起开始呈现持续减少的态势,8月开始未再有按旧1.1类申报的化药,7月则出现首个按新1类申报的化药。
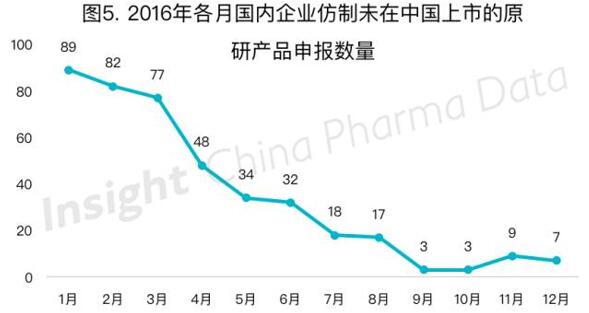
(二)新旧3类、旧6类及新4类申报数量减少
自今年4月起,按旧注册分类3.1-3.4及新注册分类3类申报的药品(国内企业仿制未在中国上市的原研产品)整体出现了大幅度下降(图5),至9月受理数量已降至5以下,11月有所回升,但申报数量未过10。
旧3.1类化药申报量今年一直呈下降趋势,据Insight数据库监控数据显示,今年9-12月均未出现按旧3.1类申报的化药。新3类的申报从8月开始首次出现,此后8-12月申报量平均每月为5个,数量较为平稳。
沙库比曲/缬沙坦及曲格列汀是今年仿制的热门药物,申报数量超过20个,其中沙库比曲有24个临床申请,曲格列汀有18个临床申请。
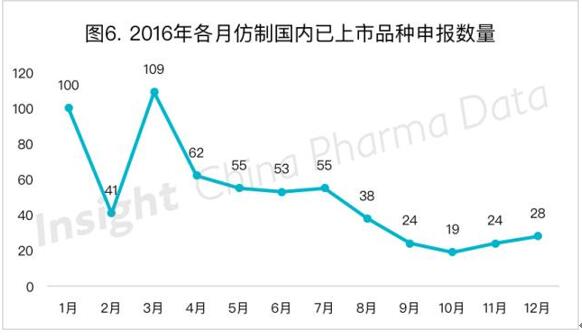
仿制国内已上市产品的化药数量(旧注册分类6以及新注册分类4)在2016年明显降低,月度承办的受理号数量与历年同期比较已不在同一个数量级。如2015年12月6类化药申报数量为114个,但2016年在年初3个月出现动荡的情况后,开始呈现显著下降的趋势(图6),这一现象与今年按1.1类申报的新药的趋势有点相似。新4类申报从8月开始首次出现,而后的申报数量维持在每月5个左右。
埃索美拉唑仍然是今年仿制国内已上市产品的热点药物,有12家企业进行该药物的上市申请,去年则有39家企业申报该药。
总体来说,仿制药申报数量较前两年有所减少,国内仿制药企业都在忙于一致性评价,仿制药的质量受到重视,一窝蜂式的集中仿制现象大幅减少,一致性评价相关的政策初显成效。
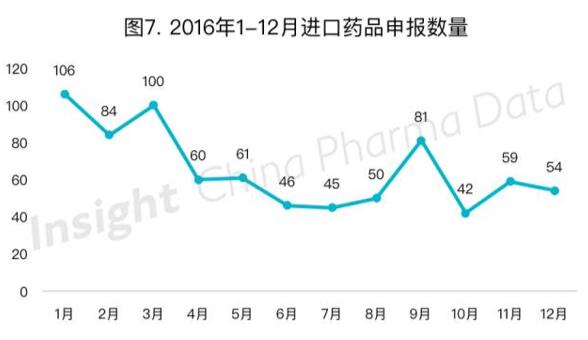
(三)进口药申报趋势总体平稳
今年进口药申报数量以受理号计为236个,总体降幅不大。每月进口药申报数量如图7所示,4月申报大幅下降,而后每月除9月稍有回升外,申报数大多在50左右徘徊。今年的进口药申报量相比2015年有所下降,但是在整体申报数量大幅下降的大环境下,我们可以认为这个下降幅度是合理的,相对来说,目前的政策对进口药影响不大。
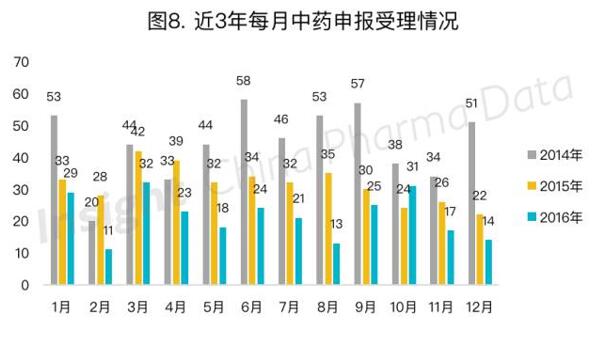
二、中药申报受理情况
根据Insight数据库数据统计显示,2016年全年申报的中药申请,以受理号计共258个,相比2015年377个下降31.6%。这一下降幅度与总体药物申报的下降幅度相比可以说是非常温和。
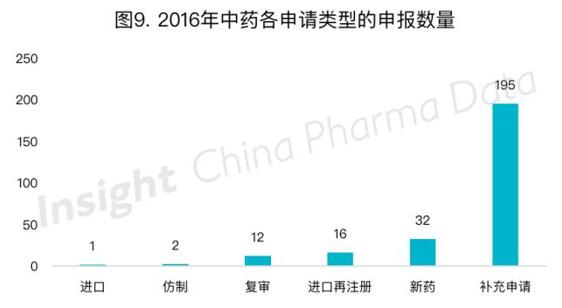
2016年的中药申请具体类型分布如图9所示:
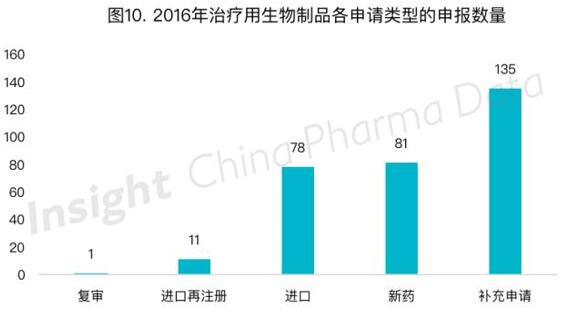
三、生物制品申报受理情况
2016年生物制品申请共396个,相比2015年的558个申请,申报量有所下降。今年治疗用生物制品申报具体类型如图10所示:
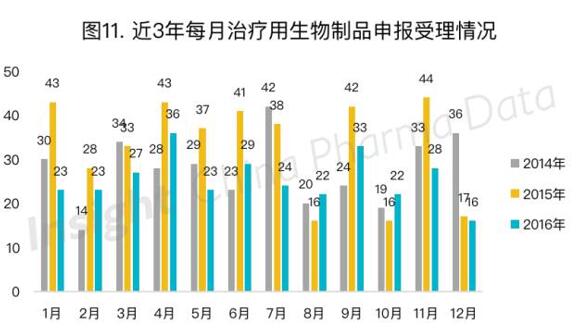
今年每月治疗用生物制品申报数量,除8月略高于2015年同期外,其余明显低于前两年。
治疗用生物制品中,1类、2类和7类的每月申报情况如图12所示。今年治疗用生物制品申报中共有24个1类新药,全部为临床申请,其中有9个品种在一年内获得临床批件。
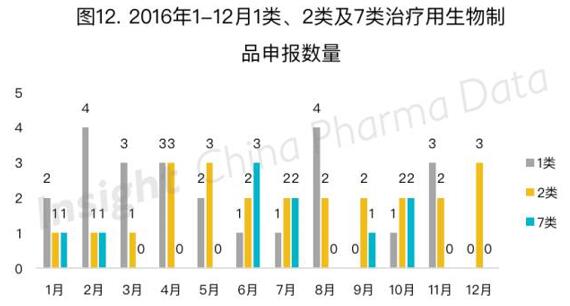
今年申报的1、2、7类治疗用生物制品中,贝伐珠单抗及其生物类似物最为热门,有6家公司申请临床。而狄诺塞单抗紧随其后,有3家公司进行了临床申请。
总的来说,今年可以说是药物申报的寒冬,经过2015年各种政策的洗礼后,今年各类药物申报均呈现下降趋势,其中申请类型为「化药新药」的申报数量受到影响最大,进口药相对较为平稳。中药及生物制品变化相对化药来说也是比较缓和的。
申报大幅减少的原因,一来各类政策出台之后大家需要一点时间逐渐摸索,比如新的药物注册分类;二来面临仿制药一致性评价以及临床自查这样严格的政策,大家变得更为谨慎。
不过从另外一角度看,整体申报数量下降也未尝不是一件好事,药监部门大刀阔斧进行改革,意在提高审评的效率和质量,提高药品质量,增加优质药品的可及性,中国制药业或可期待一个更规范有序的药品市场的到来。