来源:新康界/白小空 2015-9-2
集中审评据说8月开始实施,这边厢由于72条退审的产品纷纷表示很受伤。如何区别是死于72条还是死于集中审评?首先,72条出自《药品注册管理办法》(局令第28号)的第72条,“进口药品注册申请首先获得批准后,已经批准境内申请人进行临床试验的,可以按照药品注册申报与审批程序继续办理其申请,符合规定的,国家食品药品监督管理局批准其进行生产;申请人也可以撤回该项申请,重新提出仿制药申请。对已经受理但尚未批准进行药物临床试验的其他同品种申请予以退回,申请人可以提出仿制药申请”。而集中审评是出自《国家食品药品监督管理总局关于征求加快解决药品注册申请积压问题的若干政策意见的公告(2015年第140号)》的第六条,“积压的同品种实行集中审评。对已经受理的相同品种,按照统一的审评标准和尺度组织力量进行集中审评。对不符合规定的,及时作出不予批准的决定;符合规定的,按申报顺序依次作出审批决定并制发批准证明文件”。综上所述,可以初步判断该产品对应的进口产品上市了,且在进口药获批上市前该产品因没有获得临床批件而被退审了,十有八九死在72条。
此外,《药品注册管理办法》第66条主要针对国内药品生产企业生产首次批准的新药而设立的技术性监测制度,“国家食品药品监督管理局根据保护公众健康的要求,可以对批准生产的新药品种设立监测期。监测期自新药批准生产之日起计算,最长不得超过5年。监测期内的新药,国家食品药品监督管理局不批准其他企业生产、改变剂型和进口”。配套的还有71条“新药进入监测期之日起,不再受理其他申请人的同品种注册申请。已经受理但尚未批准进行药物临床试验的其他申请人同品种申请予以退回;新药监测期满后,申请人可以提出仿制药申请或者进口药品申请”。
笔者通过咸达数据V3.2筛选2015年6月至今“制证完毕”和“审批完毕”较多的化学药产品,得到的结果如下:
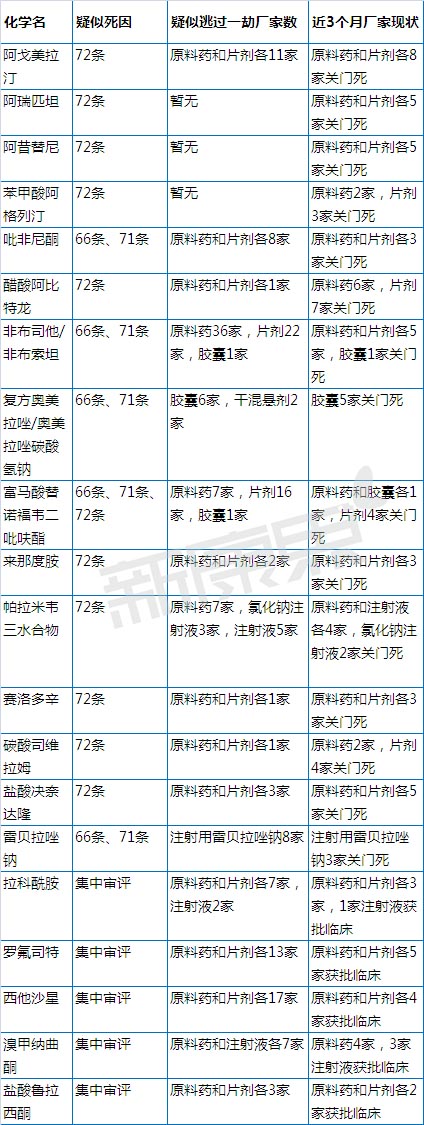
恒瑞药业是近期由于非布司他和非布司他片享受66条和71条保护的监测期获益最多的国内上市厂家。
近三个月受66条、71条或72条影响注册产品面临退审风险的上市公司有九家,分别是海正药业、康缘药业、复星医药、鲁抗医药、科伦药业、莱美药业、恒瑞医药、国药股份、福安药业,新三板1家为星昊医药。
暂时由于集中审评临床加快获益的是中国医药、方盛制药和福安药业。
小结:药品注册审评审批在加快,或者从近五个月每月的“制证完毕”或“审批完毕”受理号数看增长速度并不明显,但依法按照《药品注册管理办法》集中退审的产品越来越多。即使产品暂时由于排队临床审批速度超过外企的申报生产的速度,未来仍有一致性评价在前头等着仿制药厂家。从短期来看,天下武功唯快不破还是有一定道理的,临床获批时间比第一家获批生产的早当然好,但是第一家上市的企业岂不更妙么?