来源:丁香园 2015-06-11
5 月要点
· 5 月底药品注册费用大涨,但申报数量不减
· 广东东阳光申报 1.1 类糖尿病药物
· 广东东阳光首仿肺动脉高压药物利奥西呱
· 强生抗肿瘤药物两次临床申请不批准后,再次申报
· 浙江海正和上海药物研究院 1.1 类新药分别获批临床
根据丁香园 Insight - China Pharma Data 数据库最新统计, 2015 年 5 月 CDE 共承办新的药品注册申请有 797 个(以受理号计,下同),与 4 月份(846 个)相比仅有小幅下降。
2015 年 5 月 27 日《国家食品药品监督管理总局发布药品、医疗器械产品注册收费标准和实施细则》发布后,虽然注册费用上涨高达 100 倍,但 5 月 28 - 31 日 CDE 承办的注册受理仍有 62 个,其中新药和进口申请占了三分之一。
以下,分别来分析化药、中药、生物制品的申报受理及审评审批情况。
一、化药
申报受理情况:
5 月份 CDE 共承办新的化药注册申请以受理号计 699 个,涉及 312 个品种。其中各个申请类型的具体数据如下所示:
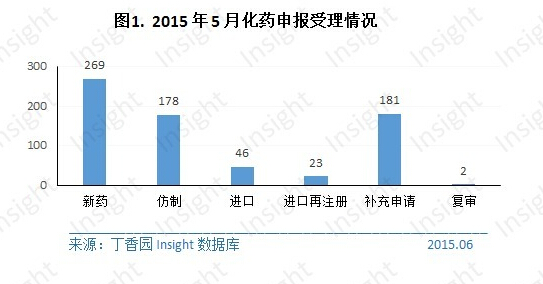
1. 新药
(1)1.1 类新药
4 个化药 1.1 类新药申报临床
根据 Insight 数据库统计,5 月份 CDE 共承办化药 1.1 类新药申请以受理号计有 10 个,涉及 4 个品种,且均为新药临床申请。具体数据如下所示:
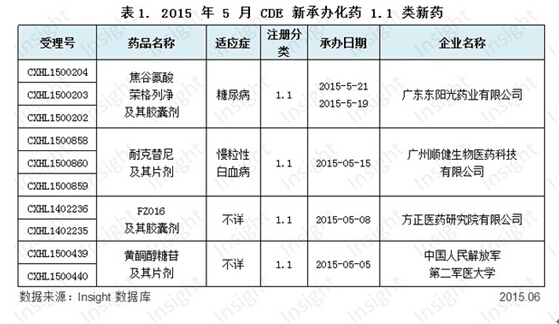
焦谷氨酸荣格列净是广东东阳光 2015 年申报的第二个 1.1 类药物,焦谷氨酸荣格列净是用于糖尿病的 SGLT2 抑制剂。广东东阳光此前申报的 1.1 类新药为抗肿瘤和丙肝药物,同时东阳光也没忘记糖尿病这片沃土。
广州顺健生物医药申报的耐克替尼,代号 GZD824,是 Bcr-Abl T315I 激酶抑制剂,用于慢粒性白血病 (Chronic myelogenous leukemia,CML),值得关注的是,该药可克服伊马替尼(格列卫)因 Bcr-Abl T315I 突变而产生的耐药性。
FZ016 的适应症暂不详。申报该药的方正医药研究院,属于北大医疗产业集团。根据 Insight 数据库,方正医药申报中的另一个药物是 3.1 类镇痛药丙戊酸半钠,同时,根据方正公司网站,其研发线上目前共有两个 1.1 类新药。
黄酮醇糖苷的适应症也未知。从中国人民解放军第二军医大学持有的专利(CN101244057 B)来看,黄酮醇糖苷可能具有降脂作用。
(2)3.1 类新药
广东东阳光首仿重磅肺动脉高压药物利奥西呱
5 月份 CDE 共承办新的化药 3.1 类新药申请以受理号计有 198 个。其中临床申请有 187 个,涉及 74 个品种;上市申请 11 个,涉及 6 个品种。
我们根据 Insight 数据库的潜力品种筛选系统,筛选出在国内首次申报 3.1 类新药的品种,它们未来或有可能成为国内首仿。具体数据如下所示:
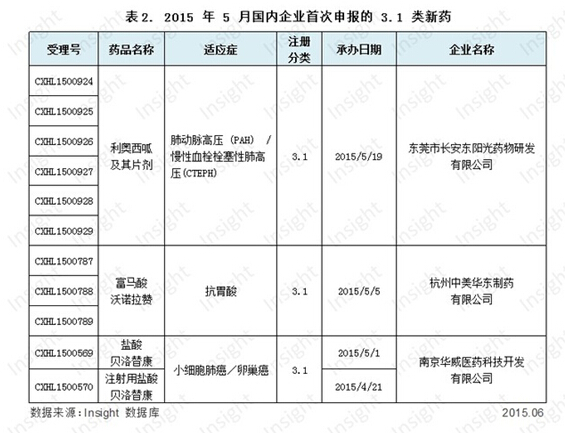
利奥西呱(Riociguat)这个可溶性鸟苷酸环化酶 (sGC) 激动剂由拜耳研发,是用于治疗肺动脉高压 (PAH) 和慢性血栓栓塞性肺高压 (CTEPH) 的重磅药。2013 年获 FDA 授予孤儿药资格并批准上市(商品名:Adempas),但在中国目前还处于临床阶段,尚未申报上市。广东东阳光以 3.1 类新药仿制申报了该药,速度虽然不快,但将来有望成为国内首仿企业。
中美华东抢仿的富马酸沃诺拉赞、喜树碱类抗癌药物贝洛替康均在 Insight 过往报告中有详细讨论,此处不再赘述。
除了中美华东快速抢仿富马酸沃诺拉赞以外,江苏豪森、瑞阳制药和天津汉康医药也在一个月内相继申报了 3.1 类的沃诺拉赞,竞争可谓激烈。
2. 仿制
心血管、消化道及代谢、抗肿瘤和抗感染仍是仿制药申报的主流领域
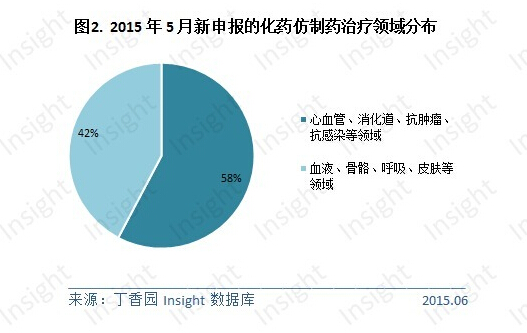
5 月份,CDE 共承办化药仿制药新申请以受理号计有 178 个,涉及 98 个品种,104 家企业(未合并同集团下子公司),数量上略低于 4 月份。抗肿瘤药物的仿制申报量有所增加,心血管系统、消化道及代谢、抗感染、抗肿瘤和神经系统用药仍是仿制药申报的主流领域,占了一半以上。
3. 进口
强生 FGFR 抑制剂 JNJ-42756493 两次临床申请不批准后,再次申报
5 月份 CDE 共承办新的化药进口注册申请以受理号计有 46 个,共涉及 29 个品种。其中,临床申请有 31 个,涉及 18 个品种,上市申请有 15 个,涉及 11 个品种。
其中,有 2 个品种首次申报国内临床,分别是凯顺富达生物科技的专利蓝 V 号钠盐注射液,以及中外制药株式会社的马沙骨化醇。
值得关注的是,强生研发的 FGFR 抑制剂 JNJ-42756493,本次在中国申报临床已是第三次,而前两次都未获批准,目前在美国处于临床二期。该抗癌药物由大冢旗下致力新型小分子疗法的 Astex 制药开发,强生制药获得其全球许可权。
化药审批情况:
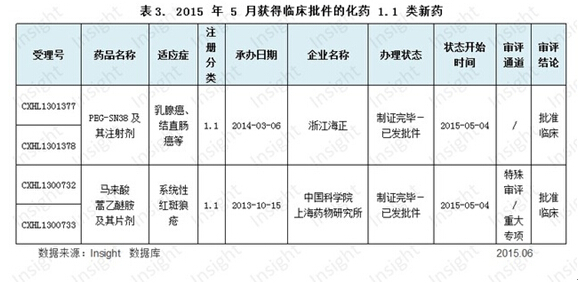
浙江海正、上海药物研究院收获 1.1 类新药临床批件
根据 Insight 数据库统计,5 月份已获得临床批件的化药 1.1 类新药有 2 个,分别为浙江海正和中科院上海药物研究所。具体数据如下所示:
二、中药
5 月份 CDE 共承办中药新申请以受理号计有 32 个,数量上略有减少。其中新药申请仅有 2 个,补充申请 27 个,复审 1 个,进口再注册 2 个。
三、生物制品
5 月份 CDE 共承办生物制品新申请以受理号计有 46 个,具体数据如下所示:
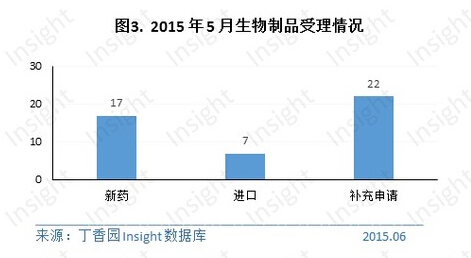
其中,仅北京康乐卫士生物技术一家企业申报了 1 类生物制品的临床申请——重组三价人乳头瘤病毒 (16/18/58 型) 疫苗 (大肠杆菌)。
虽然进口人乳头瘤病毒(HPV)疫苗的上市申请迟迟没有进展,但也没有阻挡国内企业研发 HPV 疫苗的热情。
Insight 数据库原创内容,如引用或转载请注明来源。