来源:创药网/杨益平 2015-2-9
自2013年埃博拉病毒在西非地区爆发以后,如何保护公众健康和应对突发感染性疾病得到大众和科学家们广泛关注。到2015年1月8日,这次埃博拉病毒爆发的平均致死率达到了39.4%,而在另一项研究中,使用了不同计算方法计算出的致死率达到了惊人的70%!如何控制埃博拉病毒传染以及如何治疗埃博拉病毒感染疾病成为当务之急。
总部位于瑞士日内瓦的世界卫生组织2015年1月29日发布最新埃博拉疫情报告称,自去年(2014年)6月末以来,西非埃博拉疫情重灾区每周新增病例数首次低于100例,疫情响应重点从“减缓传播”转移至“终结流行”阶段。
报告称,利比里亚和塞拉利昂疫情发病率持续下降,几内亚、利比里亚和塞拉利昂上周共报告99例新增病例,其中利比里亚仅出现4例,几内亚和塞拉利昂分别出现30例及65例新增病例。这是自去年6月29日以来,受埃博拉疫情影响最严重的西非三国每周新增病例数首次低于100例。
目前,西非这三国已实现在24小时内完成病例取样、获得最终检测结果并报告卫生部门等目标。在1月25日前的三周里,几内亚、利比里亚和塞拉利昂完成该过程的平均时间分别为0.7天、0.5天和0.8天。
报告指出,为尽早结束疫情,各方的努力方向应从快速建设基础医疗设施,转向确保病例发现、管理及安全丧葬,并让社区高效参与。
世卫组织最新数据显示,埃博拉疫情重灾区几内亚、利比里亚和塞拉利昂累计发现确诊、疑似或可能感染病例220507例,其中8795人不治身亡。
目前市场上没有药物能治疗埃博拉病毒感染,也没有疫苗能预防它,制药企业此前不愿在埃博拉治疗方面进行大量投资,因为这种病毒只是在非洲偶尔出现,治疗这种病毒感染不会带来多少回报。但是去年临床试验得以加速进行,因为西非暴发了历史上最严重的埃博拉疫情,而这一疫情,也迫使生物医药产业和世界各国政府开始正视目前治疗埃博拉病毒药物空白的这一事实。
根据汤森路透药物数据库,目前处于研发活跃期的用于预防和治疗埃博拉病毒感染药物共有28个(见表1)。其中有17个药物处于临床前阶段,8个药物处于临床一期,3个药物处于临床二期,目前还没有处于临床三期的药物。所有28个在研药物中生物制品占了绝大多数,有13个是疫苗,其中包括即将进入三期临床的葛兰素史克公司的埃博拉疫苗rChAdC3 Ebola;4个单克隆抗体药物,包括埃博拉病毒先驱药物马普生物制药公司(Mapp Biopharmaceutical)的ZMapp;小分子药物有3个,其中富士胶片公司旗下富山化学工业有限公司(Fujifilm subsidiary Toyama Chemical Co Ltd)的Favipiravir有望从众多埃博拉病毒感染药物中脱颖而出(图1)。
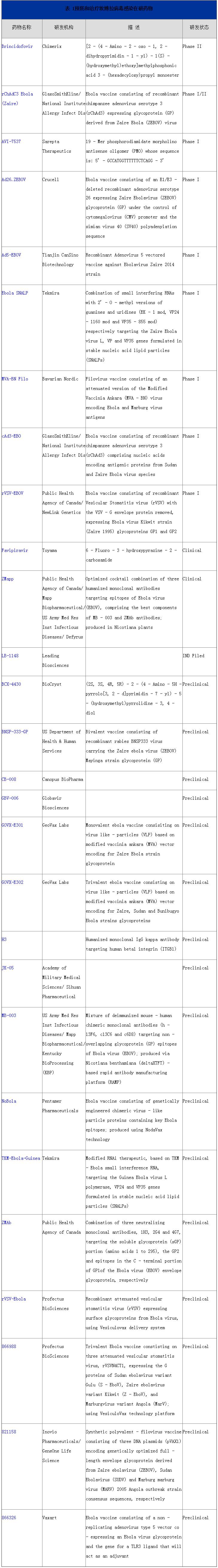
表1
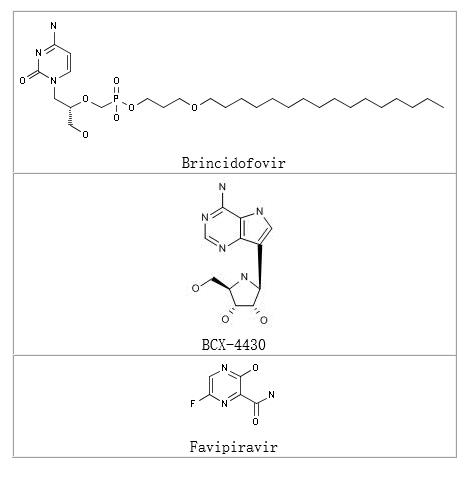
图1
埃博拉病毒疫情自2014年初在几内亚爆发以来,近期已经严重摧毁了很多西非国家。在过去的几个月中,制药公司,政府,非盈利组织和研究机构的大力协作使治疗埃博拉病毒的药物和疫苗相关研究有了快速的发展。鉴于对抗埃博拉病毒相关研究的重新重视和资金支持,目前制药巨头如葛兰素史克、默沙东、强生、罗氏等正在研究中的疫苗或抗病毒药物的一些关键研究结果可能会在2015年公布。
制药巨头葛兰素史克公司最近宣布,公司开发的首批埃博拉疫苗即将进入临床三期研究阶段。此次,葛兰素史克公司将生产的在研疫苗运输至利比里亚,并将在当地招募志愿者已进行相关研究。据悉,这一研究也是美国国家健康中心(NIH)支援西非对抗埃博拉疫情的一部分。NIH计划在当地招募约3万名患者进行相关研究,其中三分之一将接受葛兰素史克公司的疫苗产品,以判断其有效性。这种埃博拉疫苗产品在临床一期研究中表现出了良好的免疫反应和安全性。如果临床三期研究中能够获得理想效果,将对今后防止埃博拉病毒的蔓延起到重大作用。关于葛兰素史克的这一埃博拉病毒疫苗cAd3-ZEBOV的早期临床试验结果于2014年11月发表于《新英格兰杂志》(NEJM)。该疫苗为重组复制缺陷型黑猩猩3型腺病毒载体疫苗,可表达扎伊尔和苏丹属埃博拉病毒的糖蛋白。此研究表明cAd3-ZEBOV疫苗安全且具有免疫原性,并未产生严重的不良反应,20位受试者在4周内均产生埃博拉病毒的抗体。此外高剂量组的10位受试者相比于低剂量组免疫应答作用更强,产生更多的埃博拉病毒抗体,并且高剂量组产生埃博拉病毒特定的T细胞应答的受试者数多于低剂量组。诱导产生的T细胞应答是多功能的并且CD8+T细胞比例较高同时产生保护非人灵长类动物的干扰素-γ (INF-γ)和肿瘤细胞坏死因子(TNF)。良好的试验结果给予葛兰素史克极大的鼓舞,该疫苗预计将在2015年下半年投入生产。
2014年底美国卫生和人类服务部(HHS)部给予NewLink遗传学公司和葛兰素史克公司总价值约为4300万美元的合同,促进两个埃博拉疫苗加速研发进程。HHS表示,NewLink获得了3000万美元的合同,旗下生物防御系统公司将进行临床试验,以确定其疫苗产生有效免疫应答所需的最低剂量。NewLink正在开发的疫苗为rVSV-ZEBOV-GP,与美国制药商默克公司合作,后者在11月份购买了该疫苗的世界商业化权利。该合作协议还包括4100万美元的额外资金作为选择。HHS称与GSK的合同价值1290万美元,另有一个选择可以增加16000美元的资金。GSK将建立并验证制造其疫苗ChAd3 EBO-Z所需的初始物料。该公司也将提高其制造能力,从目前的数千剂提高到百万剂的量。
2014年11月24日,默沙东与NewLink Genetics公司已达成一项全球独家许可协议,共同拥有正在研究中的埃博拉病毒疫苗rVSV-EBOV的研发和商业权利,该协议授予默沙东该疫苗以及其后续产品的商业权利,该疫苗的研发者加拿大公共卫生署(PHAC)保留该疫苗的非商业权利。该疫苗为重组水泡性口炎病毒载体疫苗,能表达扎伊尔属埃博拉病毒的糖蛋白。该疫苗于2014年10月在美国进行一期临床试验,但是在12月初暂时停止主要因为瑞士日内瓦大学医院的4名受试者在接种后出现关节痛,总体来看,59名受试者中10名出现关节痛,并且疼痛未经治疗迅速消失。2015年1月5日,该实验重新开始,受试者接种的剂量减小,试验的完整结果预计将在2015年3月公布。
最近强生公司宣布,公司已经获得了欧盟下属创新药物研发中心总额高达1亿1千6百万美元的追加投资以加速其临床研究进程。目前,公司已经与包括牛津大学等世界各地多家医学研究机构在这一项目上建立紧密地合作关系。强生与美国国家过敏和传染病研究所和一家私营生物技术公司Bavarian Nordic正在研发一种联合疫苗,关键性的一期临床试验于2015年1月进行,共纳入72位健康受试者,初次接受免疫后随后加强免疫。强生公司计划到今年四月份之前,生产超过4万份疫苗进行实验;强生希望能于2015年5月在非洲和欧洲进行临床二期试验,该制药巨头已经公开宣布承诺今年生产200万支疫苗用于随后的试验和实际使用。
位于丹麦的Bavarian Nordic公司已经将其处于临床前研究的疫苗MVA-BN Filo许可给了强生公司,该公司获得了约1亿美元的前期金和4300万美元的股权投资。合作双方预计将于明年提供1百万剂量的接种疫苗,从而更好的帮助人们应对扎伊尔和苏丹这两种埃博拉病毒株和马尔堡病毒所导致的疾病。Bavarian Nordic公司用于临床试验的预防性疫苗将于2015年5月到位,可能会给生活在埃博拉疫区的人带来一点不起作用的安慰,也将可能会给正在遭受疾病折磨的人带来一点希望。
俄罗斯也在开展抗埃博拉疫苗的研究,2015年底将知道疫苗的最终试验结果。然后还必须获得所有有关对人使用的许可文件,并先在俄罗斯注册。这都需要一些时间,因此希望疫苗可以在2016年初投入大规模使用。
2014年12月29日,美国FDA批准了罗氏Lightmix埃博拉扎伊尔rRT-PCR(LightMix Ebola Zaire rRT-PCR)技术的紧急使用授权。rRT-PCR技术是一项实时RT-PCR技术,其由柏林的TIB MOLBIOL GmbH开发出来的,并由罗氏控股独家经营,可在3个小时内出结果,但只能由特定实验室在有限的时间段里探测埃博拉病毒。rRT-PCR技术可与罗氏LightCycler 480或COBAS Z 480仪器配套使用,是一项已被化学发光法高复杂性实验室或其他有资格的非美国实验室使用其进行分子诊断检测技术,或将有助于全球卫生当局对抗这种致命病毒的爆发局势。扎伊尔rRT-PCR测试是一种从与流行病学危险因素联合感染的体征和症状的个体中获取的人类EDTA全血标本中的埃博拉病毒RNA的定性检测进行实时RT-PCR检测。
除了这些大型制药公司的努力,中国天津康希诺生物技术公司正在进行扎伊尔属埃博拉病毒疫苗Ad5-EBOV的相关研发,该疫苗为重组5型腺病毒疫苗,2014年12月开始在中国进行一期临床试验,计划主要的试验和全部临床试验分别于2015年2月和6月完成。
美国斯克里普斯研究院(The Scripps Research Institute, TSRI)和马普生物制药公司(Mapp Biopharmaceutical)的研究人员正在研发三种不同的单克隆抗体(mAb)混合制剂,这种抗体混合物能与埃博拉病毒结合,从而阻止病毒扩散至健康细胞。研究显示,实验性埃博拉病毒抗体混合制剂 MB-003 和 ZMAb 可成功治疗非人类灵长类染病动物。这三种实验性疗法中最有效的一种是 ZMapp,由于数量少,在治疗了 6 名感染 EVD 的医务人员和宗教工作者(其中几人死亡)后,该抗体已告用罄。有关这种抗体混合物的作用原理的新信息可有助于开发一种急需的治疗方法,但必须有设计合理的临床试验来最终确定 ZMapp 的疗效。幸运的是,迄今为止在几内亚和塞拉利昂检测到的埃博拉病毒变异,其可被 ZMapp 抗体混合物识别的病毒位点尚未改变,这表明,新供应的 ZMapp“很可能对目前仍持续的 2014 年疫情暴发中的流行病毒株有疗效”。
除疫苗研发之外,关于治疗埃博拉病毒的抗病毒药物Favipiravir和Brincidofovir的两项临床试验正在非洲进行。到目前,这两个药物只是被特殊地用于自愿的患者,因为其治疗埃博拉病毒的效果还没有被证明。Favipiravir,由富士胶卷控股公司生产商品名为Avigan,被批准在日本用于治疗流感,其治疗埃博拉病毒的临床试验于2014年12月7日由法国医学研究所主导进行。Favipiravir体外抗埃博拉病毒效果显著,但必须进行更多的研究来评估其在人体中的效果。
评估Brincidofovir治疗埃博拉病毒效果的临床试验于2015年1月1日由英国牛津大学主导在利比里亚进行,Brincidofovir由美国Chimerix公司生产,目前正在进行其治疗病毒引起的感染包括巨细胞病毒的三期临床试验,超过500为患者参加的已经完成的5个临床试验研究结果表明其安全性良好并且体外抗病毒实验表明其有抗埃博拉病毒活性。
核苷类抗病毒药物,依赖RNA的RNA聚合酶抑制剂BCX-4430于2014年12月在英国进行一期临床试验。该药物是由BioCryst生物制药公司和美国国家过敏和传染病研究所共同研发的,BCX-4430是一个广谱的抗病毒药物,对黄热病病毒,埃博拉病毒,马尔堡病毒和线状病毒均活性。
加拿大Tekmira药业公司(Tekmira Pharmaceuticals)也开发出了一种治疗埃博拉病毒感染的siRNA化合物;Sarepta Therapeutics开发的一种反义药(an antisense drug)等都是治疗埃博拉病毒感染的潜在药物。
根据世界卫生组织的报告,2014年爆发在西非的埃博拉疫情目前已经得到了一定的控制,最近几个月埃博拉病毒的传播变得缓慢下来。但是,WHO官员仍然提醒说,目前还没有到松懈下来的时候。尽管一些药物的生产正在加速进行,但它们都是10多年前研发的产品。它们针对的是上世纪70年代埃博拉首次出现时的病毒株。由于病毒会随时间自然变异,有关药物可能不会像人们希望的那样发挥作用。自从人们研制出这些药物以来,埃博拉病毒不仅已经改变,而且在继续改变。”研究者发现,同1976年和1995年暴发的埃博拉病毒相比,目前西非的埃博拉病毒基因组有大约3%发生了改变。目前发现埃博拉病毒的10种新变异或许会干扰目前正在接受测试的药物的疗效。这10种变异中的3种是在本次西非疫情中出现的。
基于预防治疗埃博拉病毒的疫苗和药物在过去的几个月中临床试验研究去取得极大的进展,专家认为对埃博拉病毒的预防治疗2015年将是至关重要的一年,埃博拉病毒候选药物的发展需要政府和企业共同协作,不同机构间的通力协作对于埃博拉病毒预防治疗疫苗和药物的研发成功至关重要。