来源:米内网 2014-09-23
现代药物制剂的发展大致分为四个时代,第一代为普通制剂,第二代为肠溶制剂,第三代为缓控释制剂,第四代为靶向制剂。靶向给药系统(targeting drug delivery system,TDDS)也称靶向制剂或定位制剂,一般是指经某种途径给药后,药物通过特殊载体或弹头的作用特异性地浓集于靶部位的给药系统。靶向给药系统的概念由Ehrlich.P在1906年提出,代表了人类的一个美好的梦想。
普通的给药系统(drug delivery system,DDS)临床给药后,药物全身分布,大部分药物在达到作用部位之前就已经被降解代谢或消除,有效药物浓度水平低,作用时间短;而药物的全身分布还会引起其他组织器官的毒性反应。相比于普通的DDS,TDDS可靶向特定的组织和器官,进入难以达到的靶标,使靶部位的药物浓度较高,并可维持较长的时间,避免广泛分布所引起的疗效下降,以及全身分布所引起的毒性反应,减少药物用量。它是药物输送的最高境界。按靶向给药的原理,靶向制剂可分为被动靶向制剂、主动靶向制剂和物理化学靶向制剂三大类。
被动靶向主要依赖于体内的单核吞噬细胞系统,载药微粒进入体内后利用肿瘤与正常组织间血管密度与渗透性差异而产生不同的体内分布特征,或者被巨噬细胞作为异物而吞噬的自然倾向而产生靶向性。被动靶向微粒在体内的分布取决于粒径大小。主动靶向制剂通过修饰基团,如配体或抗体作为靶头发挥主动寻靶的功能。物理靶向是利用物理作用引导药物在体内定向移动和定位集中,选择性地集中在病灶部位,实现靶向给药。包括磁靶向性、动脉栓塞靶向性、热靶向性,以及pH 敏感靶向性等。
作为现代药剂学研究的热点之一,TDDS取得了良好的进展,如在微粒给药系统、微粒给药系统的表面修饰、磁性材料、前体药物、组织器官亲和性化合物的利用、药物与大分子共轭物,以及控制给药途径等方面都已有了临床应用或产品上市。而在研究内容方面,则主攻抗肿瘤的靶向给药、对一些特定组织(如直肠等)的靶向给药等等。靶向制剂作为一种理想化的剂型,其实也没有那么神秘,常用的贴膏、眼药等均属于较为简单的靶向制剂。
表1 靶向制剂的分类
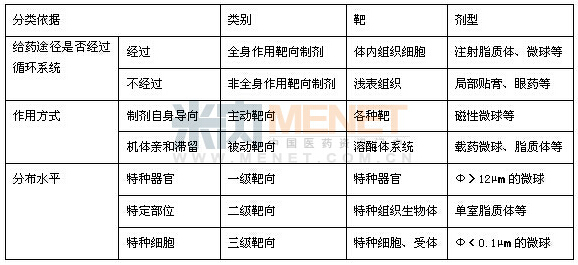
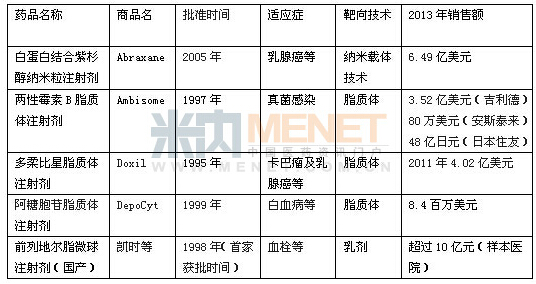
被动靶向制剂是目前研究较多也是最主要的一类靶向制剂。其中最引人注目的是脂质体、微囊与微球、纳米粒等微粒给药系统。第一个上市的脂质体注射药物是两性霉素B制剂(Ambisome),由美国Nexstar制药公司生产,1990年底首先在爱尔兰得到批准上市,随后在欧洲上市。而世界上第一个抗癌药物脂质体,多柔比星(阿霉素)脂质体(Doxil)于1995年获得FDA批准,随后获欧洲批准,用于治疗卡巴瘤。纳米技术的高速发展,也使靶向给药系统更加广泛应用于疾病的预防、诊断和治疗。2005年FDA批准的白蛋白结合紫杉醇纳米粒注射剂Abraxane,是采用专利纳米技术,将活性成分紫杉醇和只有红细胞1%大小的纳米白蛋白颗粒结合在一起,从而避免了各种溶解可能。Abraxane是第一个非溶解纳米白蛋白结合化疗药物,可以有效的利用白蛋白受体内在途径传输药物通过肿瘤新生血管内皮细胞壁。与单纯紫杉醇相比,其作用时间更长,副作用小。我国企业经过潜心研究,也打造出了具有靶向作用的前列地尔的脂微球注射剂,并取得很好的经济效益。米内网心血管病用药格局显示,在国内作为畅销品种的前列地尔,其市场占绝对优势的剂型就是脂微球注射剂。
表2 国内外部分靶向制剂的情况
脂质体作为药物载体最突出的特点就是靶向性,因而广泛地应用于抗癌药物,也成为当下化疗药物制剂研究的热点。脂质体不仅用于被动靶向,还可用单克隆抗体等配体修饰脂质体,使药物主动靶向病变部位。羊抗人抗体片段介导的多柔比星脂质体MCC-465、转铁蛋白抗体片段介导的载有DNA质粒的脂质体SGT-53等均已进入临床试验。
靶向制剂虽有给药后迅速进入病灶,主要对病灶起作用对周围正常细胞危害小,因而具有高效低毒等诸多优点。但由于技术的原因,目前市场上仅有少量靶向制剂上市,且精准制导率也远没有达到理想状态,但随着分子生物学、细胞组织学及材料学等的发展,作为“理想药物”的靶向制剂成为制剂的主流,实现百余年前人类的梦想将不会是一件难事。