来源:新康界 2014-09-05
临床研发阶段药物成功比例通常是医药投资价值评估的重要指标。新药申请过程中险关重重,一不小心企业就会陷入进退维谷的困境,而且新药申请获得批准的比例各有不同,至少在审批部门面新药并非“生而平等”。
肽类定义
新药申请首先要给予目标药物清晰的市场和适应症定位,以肽类药物研发为例透析其中奥妙,什么是肽类?生物学上肽类定义为蛋白质片段,小到二肽大到10000Da的氨基酸链,但如果仅仅这样定义显然会被FDA嘲笑。
首先,尽管FDA在2012指南草案中对肽类进行过分类,但分类依然很模糊。强生曾将氨基酸链进行过如下分类:<40个残基的为小分子,>100残基的为蛋白类,40-100个残基,无论是化学或重组合成,均被称为肽类。肽治疗基金会( Peptide Therapeutics Foundation, PTF)简化了该定义,称任何小于50残基的氨基酸链均可归为肽类,不考虑合成方法,也不考虑是否是蛋白质的 缀合物,但不包括重组蛋白。按照PTF的定义胰岛素就被排除之外了,因为它有51个残基,而且现在通过重组体生产。
其次,给药途径也是定义肽类的方法,很多医药和风投公司将肽类归为生物制剂,因为多数不能口服给药,不考虑生产方式,仅将给药途径作为分类标准的话,这种分类和FDA的观点不谋而合(Part 21 CFR 9601.2, FDA),很多组织主要参考两个分类方式:1)FDA将小分子药物与生物制剂、非新分子实体分离;2)BioMedtracker的分类包括新分子实体、单克隆抗体、蛋白质/肽类和疫苗。
治疗领域不平等
不同治疗领域获得审批的比例存在明显的差异,全身抗感染药市场申请获批的比例(24%)大约是心血管药物(9%)的三倍,而神经系统用药仅为8%。谈到治疗领域,不可避免的要讨论一下抗肿瘤药物,抗肿瘤药物中小分子药物获批的比例比肽类和大分子类略高(14%:11%),但小分子药物申请数量也较高。2012年是肽类药物的“大年”,总共有40个药物获批,其中肽类占有5个席位,看似很少,如果将2001-2012年12年间总共批准19个肽类药物作为比较,落差就十分明显了。
研发焦点不平等
大分子药物包括肽类在全球Top50的公司新药研发中比例属于少数,仅占15%,但确实是成功率最高的类群,需要注意的是其中多数是抗体类而不是肽类。另外,如果企业选择更多的适应症能够提高整体获批的比例,新分子实体第二适应症获批的比例3%,生物制剂为7%,非新分子实体为10%。但为肽类开发第二适应症的费用是弱势公司无法承担的。肽类新药用于治疗孤儿病或传统药物研发无法解决的适应症往往更吸引人们注意,2010年FDA批准tesamorelin用于治疗HIV即为一例,尽管该药物的副作用很大。
表1 2010年新药申请成功率
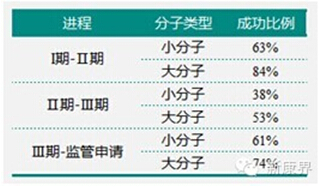
数据来源:Pharmoutsourcing
相对成功率
整体分析,新药申请进入临床阶段的整体比例为10.4%,1984-2000年肽类进入临床阶段的比例约为23-26%。在新药审批的不同时期,大分子药物的获批比例均高于小分子药物(表1),原因在于大分子药物的适应症范围更广,奇怪的是单克隆抗体类成功比例仅略高于肽类。I期和Ⅲ期的成功率高于Ⅱ期,因为I期主要是安全性验证,Ⅱ期为概念性验证,相对比较关键。
表2 2013年新药申请成功率
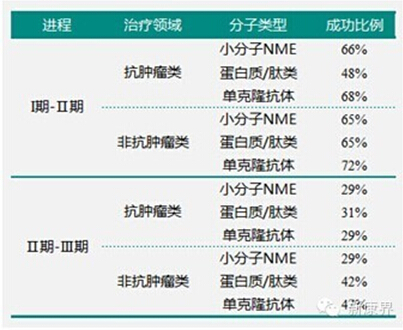
数据来源:Pharmoutsourcing
抗肿瘤和非抗肿瘤小分子实体从I期进入Ⅱ期的比例分别为66%和65%,而蛋白质/肽类的比例为48%和65%,单克隆抗体的比例最高,分别为68%和72%。从Ⅱ期进入Ⅲ期时,蛋白质/肽类的表现优于小分子实体(表2),而且肽类在临床试验的晚期保持较高的获批比例,几乎和抗体类持平(表2)。Ⅲ期后,肽类药物成功的比例更高,64%的比例获得新药申请审批,其中93%的新药获得多个适应症。