 产业资讯
产业资讯
 米内网
米内网  2021-09-08
2021-09-08
 2996
2996
摘要
8月CDE共承办药品注册申请1090件
8个存量品种首次有企业申报一致性评价
康方生物再提交派安普利单抗注射液上市申请
仿制申请有15个品种,进口申请有1个品种暂无国产获批
2个1类新药获批,3个首仿品种获批,15个品种迎来首家过评
CDE总体承办情况
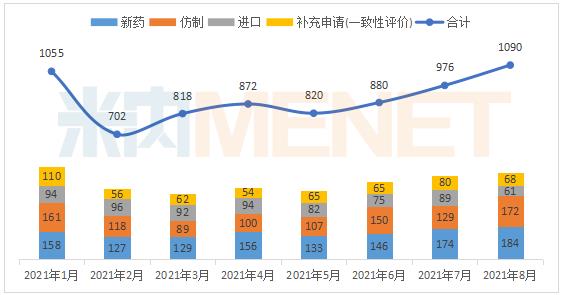
据米内网MED2.0中国药品审评数据库统计,2021年8月CDE共承办药品注册申请1090件。
2021年1月-8月CDE承办药品注册申请情况(按受理号计)
一致性评价补充申请承办情况
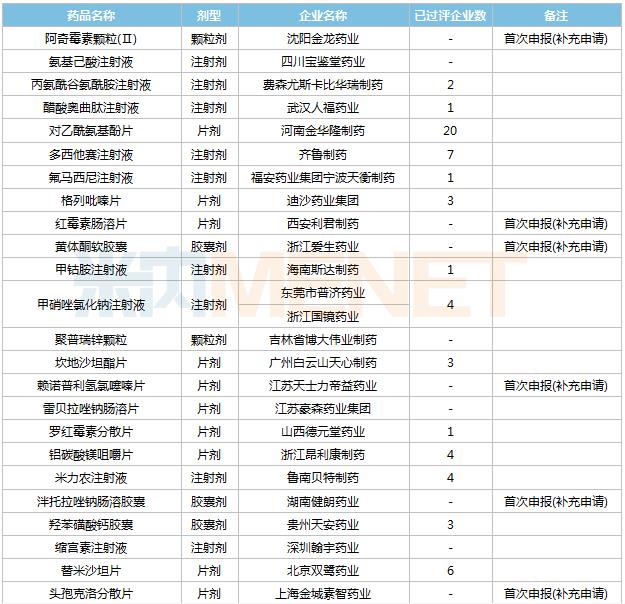
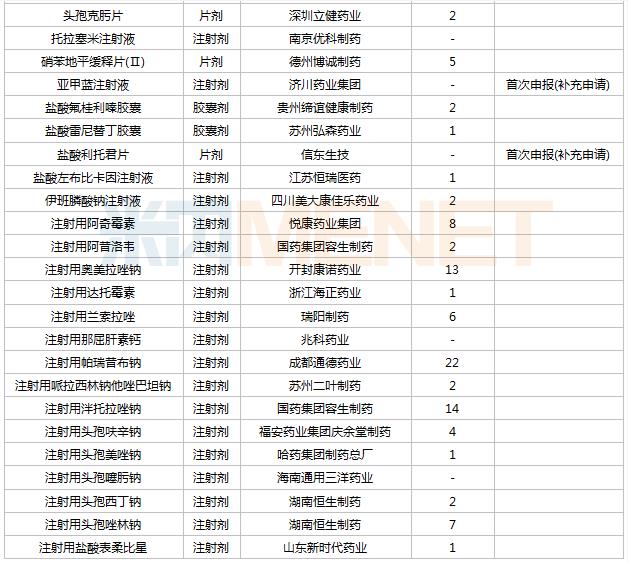
2021年8月,48个品种的一致性评价补充申请获CDE承办。8个品种为首次提交一致性评价补充申请:阿奇霉素颗粒(Ⅱ)、红霉素肠溶片、黄体酮软胶囊、赖诺普利氢氯噻嗪片、泮托拉唑钠肠溶胶囊、头孢克洛分散片、亚甲蓝注射液、盐酸利托君片。详细情况见下表:
8月CDE补充申请(一致性评价)品种承办情况
新药申请承办情况
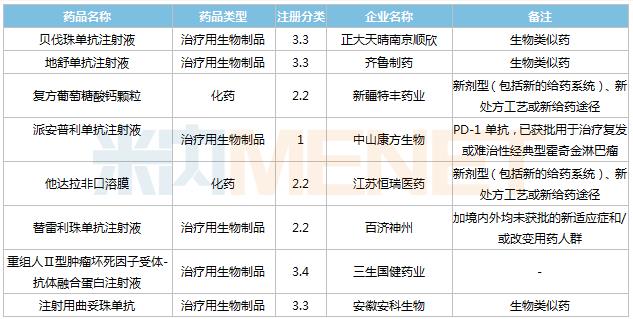
2021年8月,114个品种的新药申请获CDE承办。其中1类新药有81个,2类改良型新药有22个,3.3类生物类似药8个。
中山康方生物再提交派安普利单抗注射液上市申请,推测为新适应症,目前该药已获批用于治疗复发或难治性经典型霍奇金淋巴瘤。正大天晴、齐鲁制药以及安徽安科生物均有生物类似药上市申请。
8月国内新药上市申请承办情况
8月国内新药临床申请承办情况
仿制申请承办情况
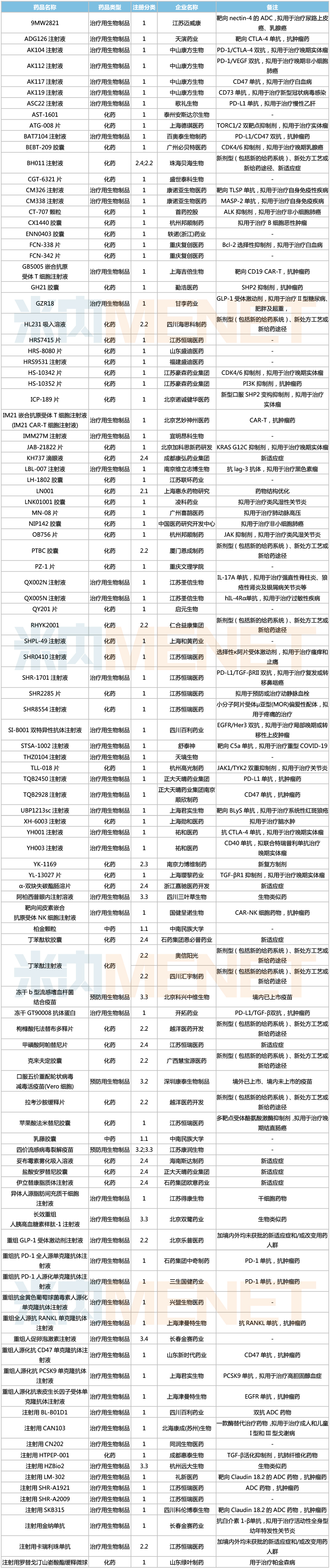
2021年8月,110个品种的仿制申请获CDE承办,其中15个品种暂无国产获批:艾地骨化醇软胶囊、巴瑞替尼片、吡仑帕奈片、法维拉韦片、琥珀酸去甲文拉法辛缓释片、甲苯磺酸艾多沙班片、利丙双卡因乳膏、磷酸特地唑胺片、瑞戈非尼片、沙美特罗替卡松吸入粉雾剂、舒更葡糖钠注射液、吸入用盐酸溴己新溶液、盐酸普拉格雷片、注射用高纯度尿促性素、注射用磷酸特地唑胺。详细情况见下表:
8月国内仿制申请承办情况
进口申请承办情况
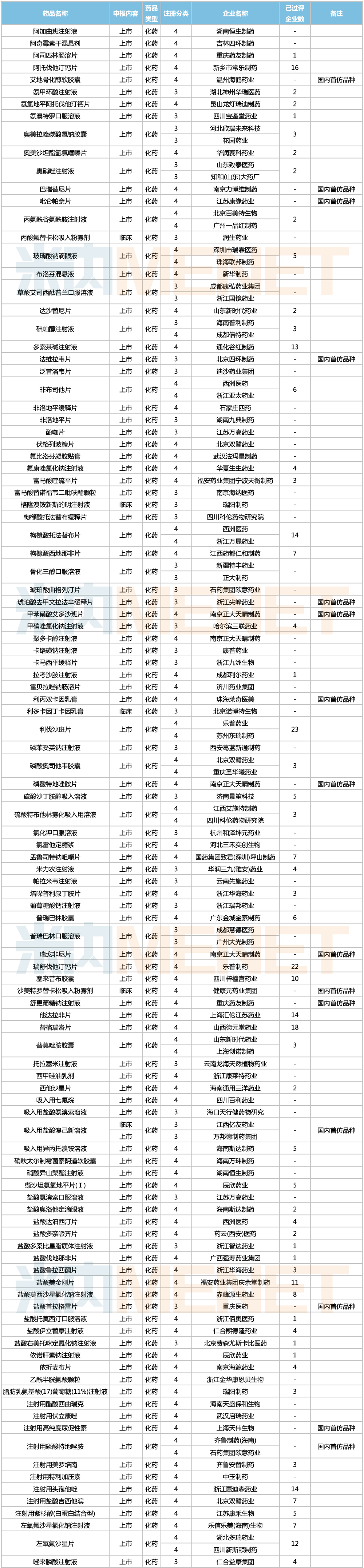
2021年8月,49个品种的进口申请获CDE承办。其中1类新药有32个,2类改良型新药有6个,5.1类进口原研药有5个,5.2类进口仿制药有4个。美法仑片暂无国产获批。
8月进口上市申请承办情况
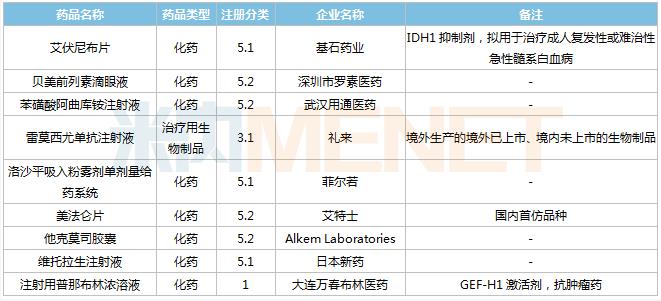
8月进口临床申请承办情况
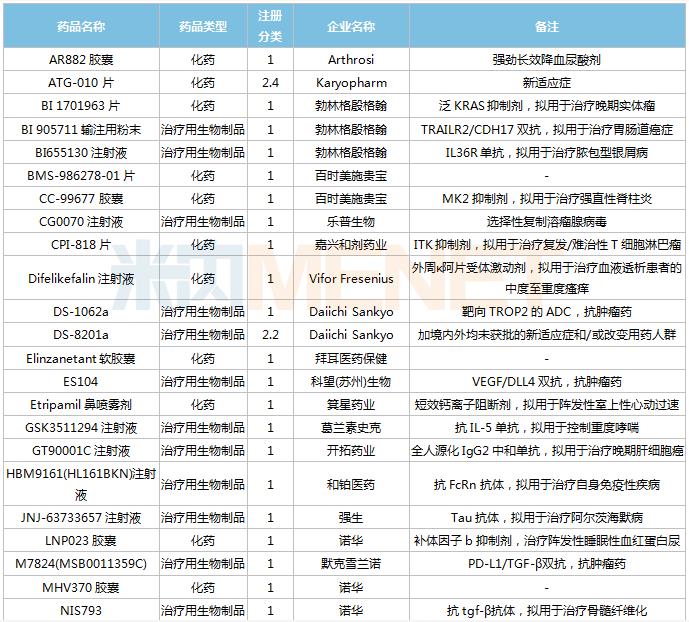
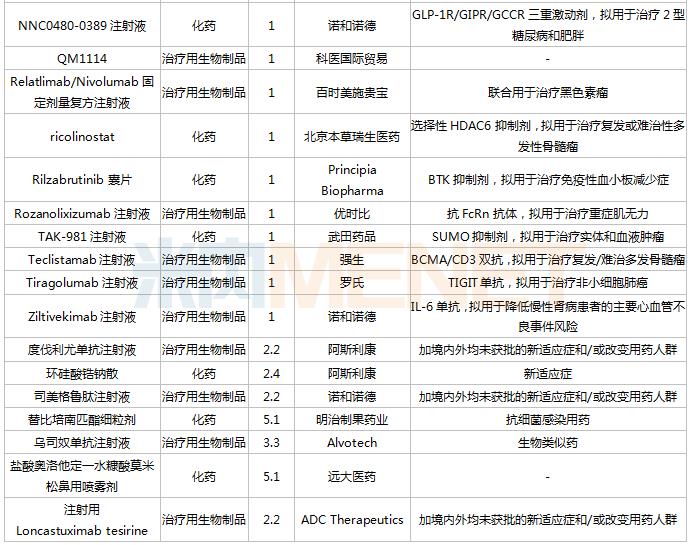
获批情况
2021年8月,正大天晴康方(上海)生物派安普利单抗注射液、广州誉衡生物赛帕利单抗注射液等两个1类新药获批。
44个仿制药获批,艾考糊精腹膜透析液(广州百特医疗)、恩扎卢胺软胶囊(江苏豪森药业集团)、盐酸安非他酮缓释片(Ⅱ)(宜昌人福药业)等品种为国内首仿获批。
55个存量品种有企业过评,阿奇霉素颗粒(长春雷允上药业)、阿司匹林肠溶片(辰欣药业)、氨茶碱注射液(天津金耀药业)、奥硝唑分散片(湖南九典制药)、苯妥英钠片(苏州弘森药业)、碘佛醇注射液(江苏恒瑞医药)、甘油果糖氯化钠注射液(天津金耀集团湖北天药药业)、酒石酸美托洛尔注射液(宜昌人福药业)、尼美舒利分散片(湖北舒邦药业)、匹伐他汀钙分散片(浙江京新药业)、头孢泊肟酯干混悬剂(海南三叶美好制药)、盐酸纳洛酮注射液(成都苑东生物制药)、异烟肼注射液(天津金耀药业)、重酒石酸去甲肾上腺素注射液(远大医药)、注射用阿莫西林钠克拉维酸钾(华北制药)等品种为首家企业过评。
8月上市申请品种及一致性评价品种获批情况

 产业资讯
产业资讯
 医麦创新药
医麦创新药  2025-08-04
2025-08-04
 67
67

 产业资讯
产业资讯
 药时空
药时空  2025-08-04
2025-08-04
 67
67

 产业资讯
产业资讯
 Medaverse
Medaverse  2025-08-04
2025-08-04
 62
62