 产业资讯
产业资讯
 米内网
米内网  2021-09-14
2021-09-14
 2524
2524
精彩内容
1类新药!国内第2款CAR-T产品获批;
超100亿市场!第6款国产PD-1单抗获批;
首家报产!华东医药进攻近$40亿大品种;
齐鲁生物类似药报产,创新药获批临床;
健康元发力,国内首款吸入抗生素报产;
市场空白!苑东首款1类生物药获批临床;
正大天晴、信达......30款1类新药亮相。
10款新药上市有进展!国内第2款CAR-T获批
8月28日-9月10日期间,10个新药(13个受理号)的上市申请审批/制证完毕。国产新药中,2款1类新药获批上市,为药明生物/誉衡生物的赛帕利单抗及药明巨诺的瑞基仑赛;进口新药中,赛诺菲的度普利尤单抗、默沙东的帕博利珠单抗、百时美施贵宝的纳武利尤单抗等新适应症获批。
多款新药的上市申请撤回或不批准,包括武田的伏诺拉生、辉凌医药的美沙拉秦等。
(8.28-9.10)新药上市申请审评审批状态更新
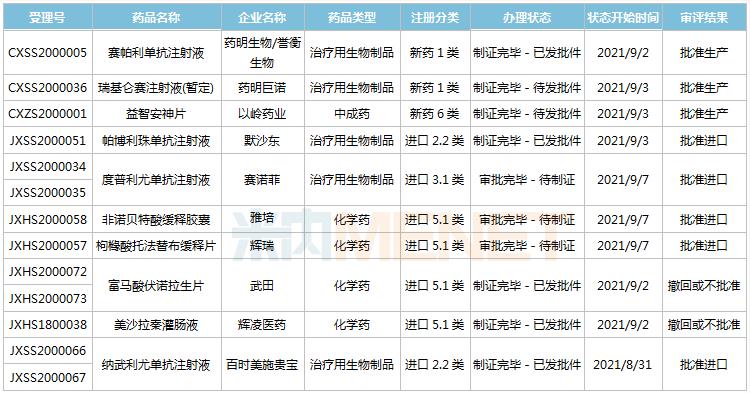
药明巨诺的瑞基仑赛(JWCAR029)是国内第2款、全球第6款获批上市的CAR-T产品,同时也是国内首个获批的1类CAR-T产品。瑞基仑赛是国内首款获批临床的以CD19为靶点的CAR-T产品,但复星医药的3.3类新药阿基仑赛(从Kite引进的Yescarta)率先获批上市,拿下国内首款CAR-T产品。
誉衡生物/药明生物的赛帕利单抗是国内第6款获批上市的国产PD-1单抗,用于治疗二线以上复发或难治性经典型霍奇金淋巴瘤。目前国内已有8款PD-1单抗获批,米内网数据显示,2020年国内PD-1单抗市场规模已超过100亿元,同比增长114.7%。
2款进口PD-1单抗新适应症获批,默沙东的帕博利珠单抗拿下国内第8个适应症,用于食管癌一线治疗,该产品在2021年H1全球销售收入80.78亿美元,同比增长23%;百时美施贵宝的纳武利尤单抗拿下国内第4个适应症,用于胃癌一线免疫治疗,该产品在2021年H1全球销售收入为36.30亿美元,同比增长6%。
度普利尤单抗第2个适应症获批,用于12岁及以上青少年及成人的中重度特应性皮炎。这是赛诺菲研发的一款靶向IL-4Rα的人源性单克隆抗体,可同时阻断IL-4和IL-13信号通路,是FDA批准的首个用于成人中重度特应性皮炎的靶向生物药,2020年全球销售额已达40.53亿美元。
11款新药申请上市!2款重磅生物类似药首家报产
8月28日-9月10日期间,11个新药(17个受理号)上市申请获得CDE承办。2款重磅生物类似药迎首家报产企业,为齐鲁的地舒单抗及华东的利拉鲁肽;银杏树/以岭万洲国际的1类新药赛拉瑞韦、施维雅的阿托伐他汀培哚普利氨氯地平、琅铧医药的替洛利生等首次提交上市申请。
(8.28-9.10)获承办的国产/进口新药上市申请
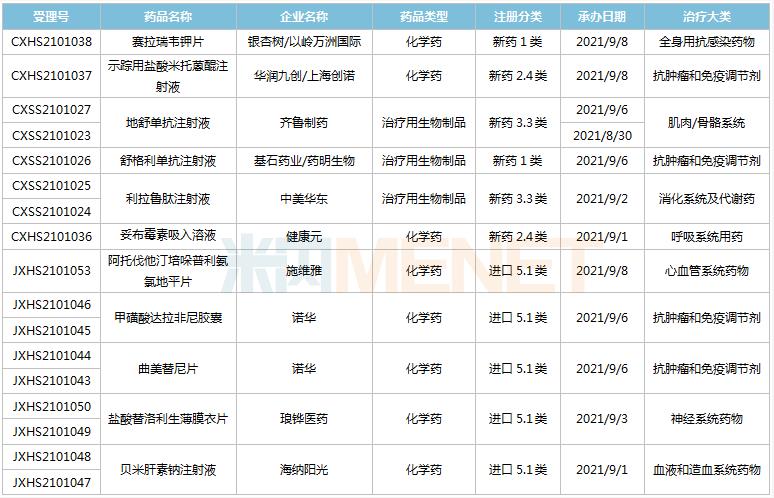
地舒单抗是安进开发的一款“first-in-class”抗RANKL单抗,2020年全球销售额约50亿美元。2019年5月获批进入国内市场,2020年通过谈判降价80%进入国家医保乙类目录。齐鲁的产品是国内首款报产的地舒单抗生物类似药,此外康宁杰瑞、上海迈威、山东博安等企业的产品处于III期临床。在生物类似药方面,目前齐鲁已有1款产品获批,2款产品报产,还有多款产品步入III期临床。
利拉鲁肽是由诺和诺德研发的一款人胰高血糖素样肽1(GLP-1)类似物,具有促进胰岛素分泌、保护胰岛β细胞、延迟胃排空降低食欲等多种生理功能。该产品最早于2010年在美国获批上市,2020年全球销售额243.55亿丹麦克朗(约38.9亿美元)。2011年获批进入国内市场,2017年通过谈判纳入国家医保乙类目录,2020年在中国公立医疗机构及中国城市实体药店终端合计销售额超过13亿元。华东医药的产品是国内首款报产的利拉鲁肽类似药,此外还有多家企业的产品进入III期临床,包括通化东宝、正大天晴、东阳光、珠海联邦、万邦生化等。
健康元的妥布霉素吸入溶液是针对我国支气管扩张症的高发病率和临床药物匮乏的现状而研制出来的抗菌药物新型吸入制剂,是国内首款提交上市申请的吸入抗生素类药物。米内网数据显示,近年来,受限输限抗等政策影响,国内全身用抗细菌药市场承压,增速逐年放缓,2020年叠加疫情影响,增速首次出现下滑。
齐鲁、豪森、石药......78个新药获批临床
8月28日-9月10日期间,78个新药(139个受理号)获得临床试验默示许可。其中,51个品种(87个受理号)为国产新药,27个品种(52个受理号)为进口新药。从药品类型看,化学药有44个、治疗用生物制品有31个、中成药有3个。51个国产新药中,1类新药有42个。
(8.28-9.10)获批临床的国产/进口新药
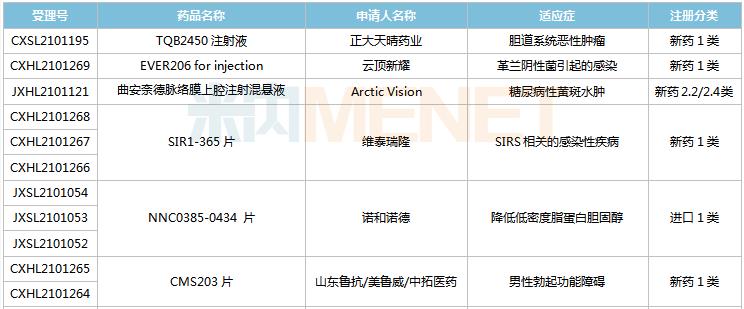
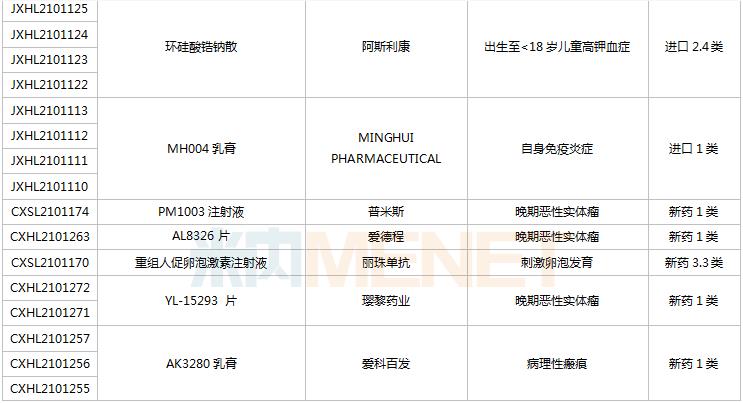
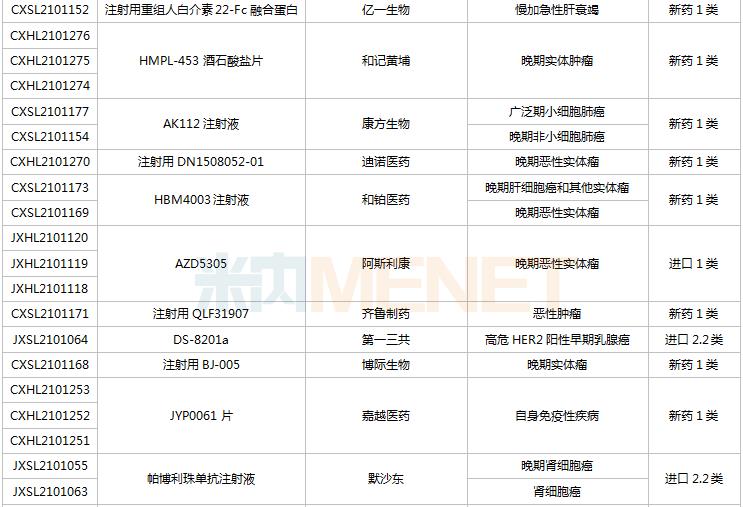
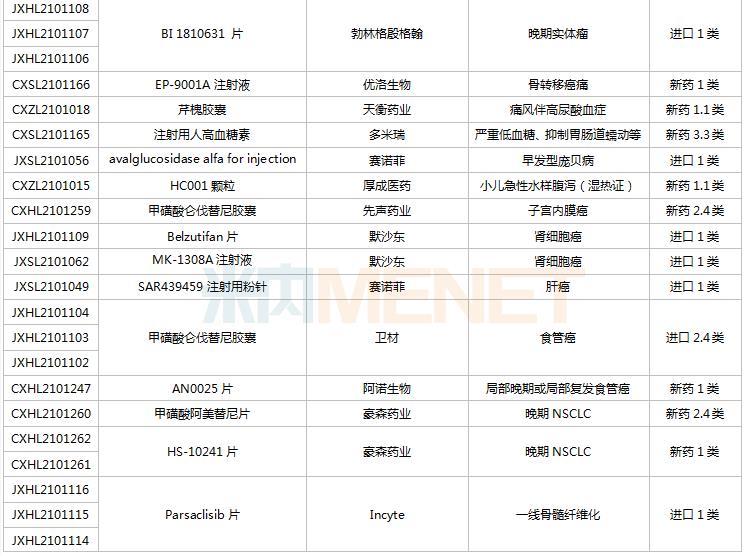
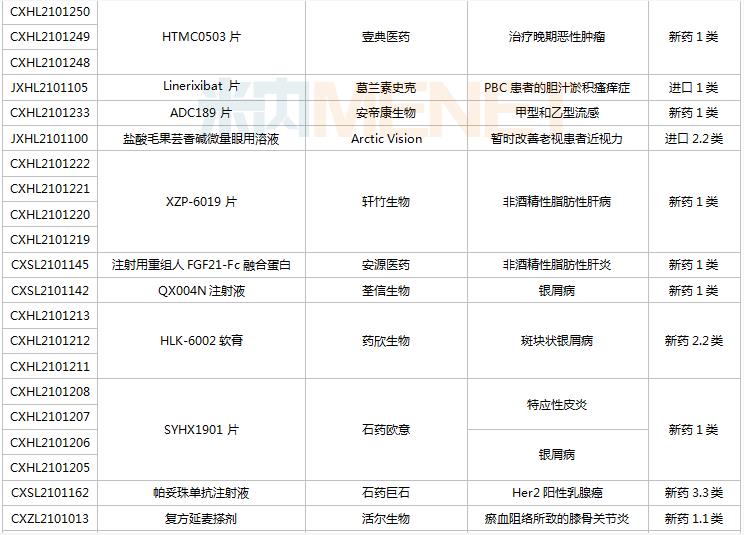
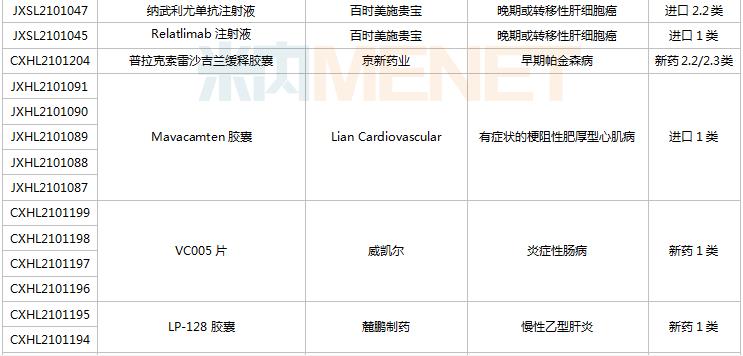
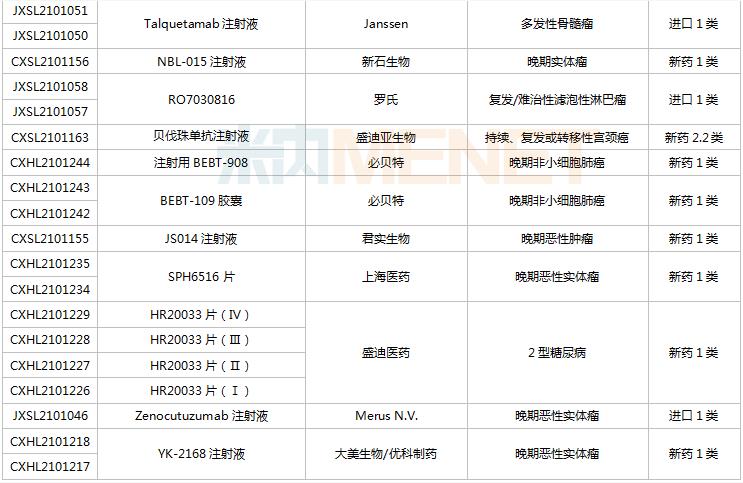
默沙东有3款新药获批临床。Belzutifan片是一款新型、强效、选择性口服缺氧诱导因子(HIF-2α)抑制剂,是FDA批准的首个HIF-2α抑制剂,其靶向信号通路的相关研究曾于2019年荣获诺贝尔生理学或医学奖;MK-1308A注射液是MK-1308(CTLA-4抗体)和pembrolizumab(PD-1单抗)的联合治疗方案,国内最高研发进展已进入II期临床,用于治疗晚期肝细胞癌。
普米斯两款双抗获批临床,PM8001注射液是一款PD-L1/TGF-β的双特异性抗体,拟开发用于晚期肺癌,国内最高研发进展已在进行I/IIa期临床研究;PM1003注射液是一款PD-L1/4-1BB双特异性抗体,拟开发用于晚期恶性实体瘤,此次为首次在国内获批临床。
首次获批临床的注射用QLF31907是齐鲁制药自主研发的靶向细胞程序性死亡-配体1(PD-L1)和4-1BB(CD137)的双特异性抗体,双管齐下增强抗肿瘤药物的有效率。齐鲁制药生物药迎大爆发,2021年至今有7款生物创新药申报临床(6款为首次申报),其中注射用QLS31905(双抗)、注射用QLS31901(双抗)等已启动I期临床。
安帝康生物的ADC189片属于Cap依赖型核酸内切酶抑制剂,通过抑制流感病毒中的CAP帽子结构依赖性内切核酸酶,是具有全新作用机制的抗流感药物,此次为首次获批临床。头对头研究数据显示,与同靶点对照药物相比,ADC189具有无中枢神经系统副作用、口服吸收不受食物影响、更高安全剂量等优势,显示出“best-in-class”的特征。
首次获批临床的EP-9001A注射液是优洛生物(苑东生物全资子公司)首个自主研发的1类生物药,EP-9001A是一款靶向人神经生长因子(NGF)的单克隆抗体,通过选择性靶向结合并抑制NGF,阻止来自肌肉、皮肤和器官的疼痛信号进入脊髓和大脑,具有其他镇痛药不同的作用机制,目前国内外尚无同类产品获批上市。
首次获批临床的JS014注射液是君实生物以6650万美元引进的一款重组白介素21受体(IL21)融合蛋白,是国内首款IL21/HSA融合蛋白,能高亲和力特异性地结合人IL-21R并激活淋巴细胞。全球范围内有4款靶向IL21的产品进入临床开发,除JS014外,两款单抗ATR-107(PF-05230900)和avizakimab(BOS161721)分别处于临床I期和II期阶段;安进的AMG256为PD-1/IL21双功能融合蛋白,已启动I期临床。
阿斯利康首次获批临床的AZD5305是一款PARP1选择性抑制剂,有望克服已上市PARP抑制剂的副作用,包括肠道毒性或血液学毒性。在临床前毒理学模型中,AZD5305显示出了优于奥拉帕利的特性,目前该产品在国外处于I期临床。
RO7247669是罗氏开发的一款靶向PD-1和LAG-3的双特异性抗体,LAG-3和PD-1介导不同的信号通路,但可能产生协同作用,导致效应T细胞的耗竭。该产品全球范围内正在开展I/II期临床试验,此次首次在中国获批临床,用于治疗肝癌。
正大天晴、海思科、信达……42个新药临床申请获承办
8月28日-9月10日期间,42个新药(涉及57个受理号)的临床申请获CDE承办受理。其中,35个品种(50个受理号)为国产新药,7个品种(7个受理号)为进口新药。从药物类型看,化学药有19个、治疗用生物制品有20个、中成药有3个。35个国产新药中,1类新药有30个。
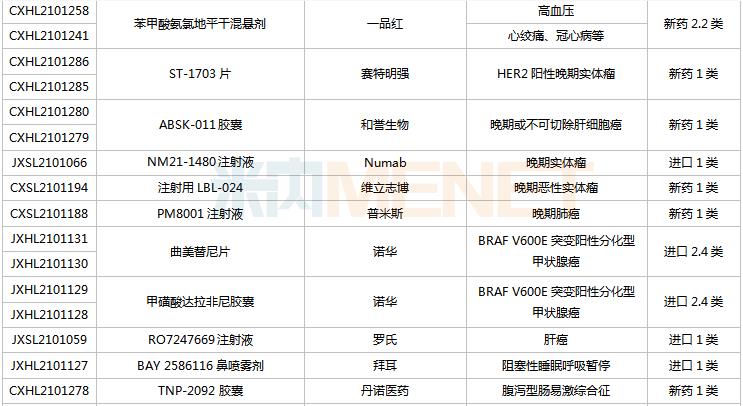
(8.28-9.10)获承办的国产/进口新药临床申请
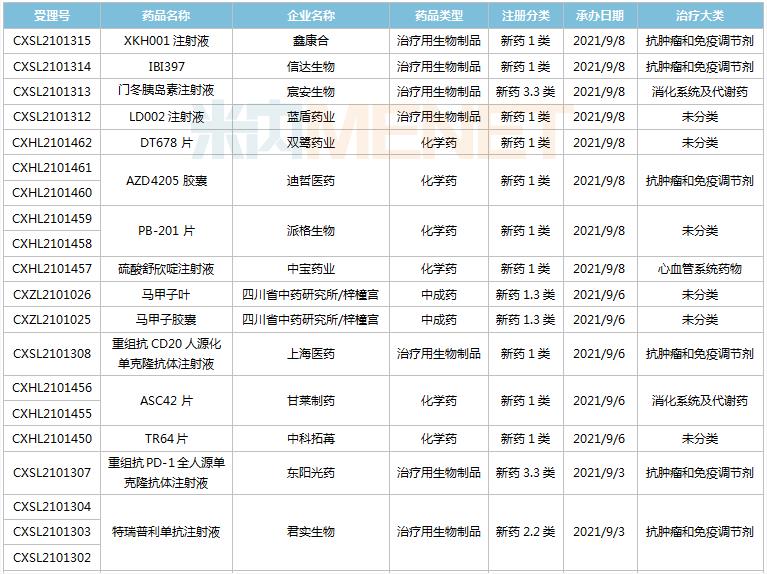
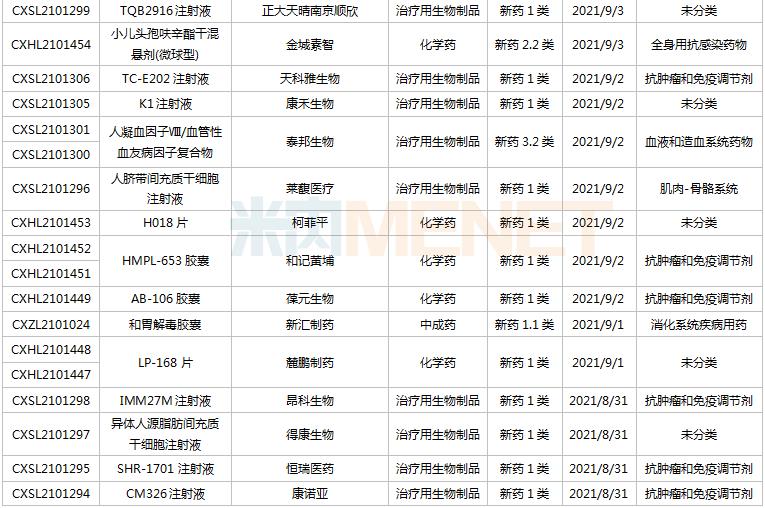
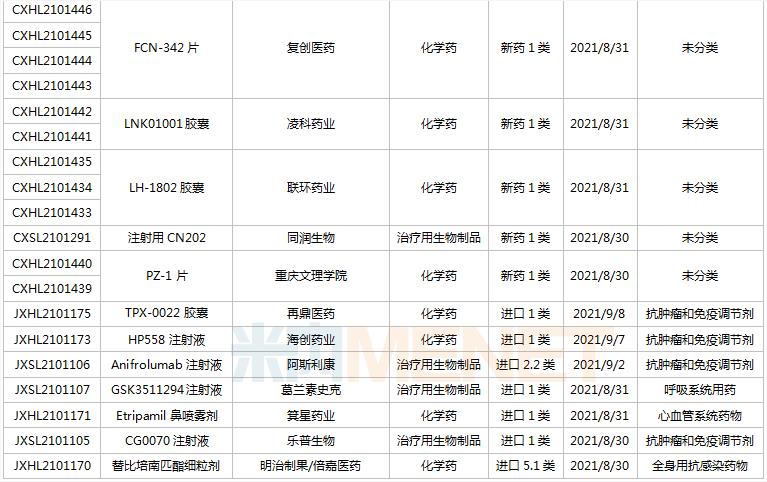
首次在国内申报临床的IBI397是信达生物引进的一款具有独特双机理的首创SIRP-alpha抑制剂,具有差异化机制,可以同时提供免疫激活信号并解除免疫抑制信号。目前该产品在国内外均未启动临床。信达已经针对CD47-SIRPα布局了3款产品,包括CD47单抗IBI188(letaplimab)、PD-L1/CD47双抗IBI322以及SIRPα单抗IBI397.
东阳光药的重组抗PD-1全人源单克隆抗体注射液是国内第2款申报临床的PD-1生物类似药,推测为纳武利尤单抗生物类似药。国内首个申报临床的PD-1生物类似药为山东博安生物的LY01015.该产品目前已获批临床。
TPX-0022胶囊是再鼎医药超3.6亿美元引进的一款口服多靶点激酶抑制剂,其全新的大环结构可抑制MET、CSF1R和SRC基因靶点突变,此次为首次在国内申报临床,全球最高研发进展处于I期临床。
数据来源:米内网数据库、CDE、公司公告。数据统计时间段为8月28日-9月10日,按药品名称统计(不含预防用生物制品、体外诊断试剂等,不含补充申请),如有疏漏,欢迎指正!

 产业资讯
产业资讯
 医药投资部落
医药投资部落  2025-05-02
2025-05-02
 136
136

 产业资讯
产业资讯
 赛柏蓝
赛柏蓝  2025-05-02
2025-05-02
 138
138

 产业资讯
产业资讯
 瞪羚社
瞪羚社  2025-05-01
2025-05-01
 219
219