 产业资讯
产业资讯
 Insight数据库
Insight数据库  2021-10-11
2021-10-11
 3927
3927
10 月 7 日,亿帆医药宣布控股子公司亿一生物于欧洲当地时间 2021 年 9 月 30 日收到 EMA 签发的受理函,EMA 正式确认并受理亿一生物自主研发的在研品种重组人粒细胞集落刺激因子-Fc 融合蛋白(F-627.贝格司亭)用于预防及治疗肿瘤患者在化疗过程中引起的嗜中性粒细胞减少症的上市许可申请(MAA),并进入审评程序。

来自:企业公告
这是 F-627 在全球范围内递交的第 2 项新药上市申请。2021 年 3 月 30 日,F-627 向美国 FDA 提交 BLA 申请,2021 年 5 月 27 日晚收到美国食品药品管理局 (FDA) 的受理函,正式接受 F-627 的上市申请。而在中国,正大天晴于 8 月 30 日以2.1 亿元+分级净销售额提成获得了该药的独家权益,亿帆医药预计于今年年底或明年年初在国内递交上市申请,在 2022 年取得批准。
F-627 是亿一生物的首个商业化产品。该药基于亿一生物具有自主知识产权的 Di-KineTM 双分子技术平台开发,是基于 Fc 融合蛋白技术,由 CHO 细胞表达的 rhG-CSF 二聚体,具有长效和强效的生物学特点,目前 F-627 主要应用于预防及治疗肿瘤患者在化疗过程中引起的嗜中性粒细胞减少症,可使肿瘤化疗患者嗜中性粒细胞迅速增殖和恢复,从而增强了免疫系统抵抗感染的能力,以防止患者在化疗期间死于感染或者其他相关并发症。
据亿帆医药公告,F-627 作为唯一一个非 PEG 修饰的产品,具有差异化优势。在先期欧美中报批之后,还将在全球其他国家或地区市场寻求上市。F-627 全球开发计划全面,涵盖了美国、欧盟、澳大利亚和中国等多个国家和地区,也覆盖了主要的一线化疗用药,并且是目前全球唯一一个和原研的长效(培非格司亭)和短效 G-CSF(非格司亭)都做过头对头对比试验的长效 G-CSF,从 I 期到 III 期全球一共 10 个临床 1200 名病人,充分的临床数据有利于其全球报批。
贝格司亭国内项目详情
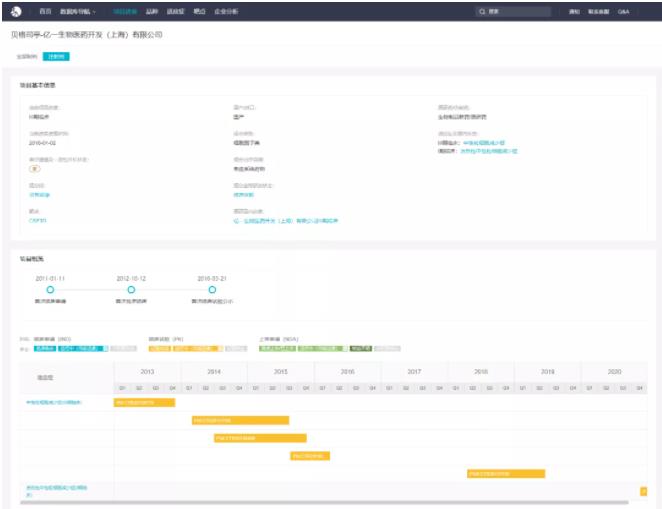
来自:Insight 数据库(http://db.dxy.cn/v5/)
G-CSF 市场广阔。据 2019 年《柳叶刀肿瘤学》在线发表一项基于人口学的研究预测,2019 年全球肿瘤患者是 1.929 万人,至 2040 年全球肿瘤患者预计约 2.600 万人,其中中国预计会达到 625 万。虽然如今癌症疗法正在不断迭代,化疗仍是重要治疗方案,针对化疗导致的中性粒细胞减少治疗需求庞大。2020 年整体市场已有约 80 亿元规模,而长效 G-CSF 市场已达 65% 的市场份额。

 产业资讯
产业资讯
 智药局
智药局  2025-12-15
2025-12-15
 115
115

 产业资讯
产业资讯
 Medaverse
Medaverse  2025-12-15
2025-12-15
 105
105

 产业资讯
产业资讯
 生物药大时代
生物药大时代  2025-12-15
2025-12-15
 94
94