 产业资讯
产业资讯
 研发客
研发客  2021-10-15
2021-10-15
 2612
2612
自国家药品监督管理局2017年加入国际人用药品注册技术协调会(ICH)以来,药监部门密集出台一系列鼓励创新药研发的政策,这一段时期也是中国制药企业创新活力得到强烈激发的时期。药监、研究者和工业界在持续提高审评、药品研发和生产标准方面取得了长足的进步。这些变化,在2018~2020年药品审评年报告中得以窥见一二。
1. 三年申报审批变化
随着2019年12月1日施行的新版《疫苗管理法》、《药品管理法》、2020年7月1日实施的《药品注册管理办法》及三年间由药品审评中心 (简称药审中心)牵头撰写的145项技术指南出台、12个ICH指导原则的落地实施,众多行业人呼吁构建的以审评流程为导向的科学管理体系、临床试验默示许可、鼓励和接受境外临床试验数据和临床急需新药、优先审评、预约制的沟通交流会议等政策得以实现。
从2018~2020年创新药审批品种来看,越来越多国内生物技术企业敢梦想、敢尝试。
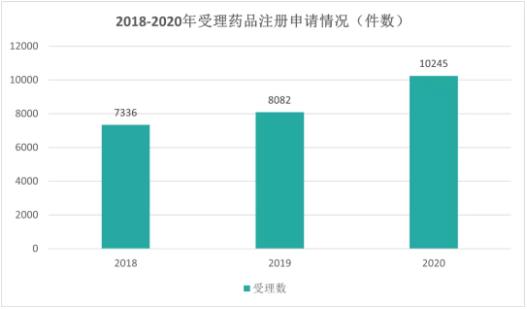
2018~2020年,我国受理新药新注册申请持续升高。2018年,药审中心受理中药、化学药、生物制品申请共7336件(以受理号计,下同)。2019年,受理的新注册申请共8082件,到了2020年,这一数字达10.245件,三年间共增长40%,增幅大于历年水平。医药产业依旧是快速发展的朝阳产业,吸引了不少弄潮儿加入这一领域。
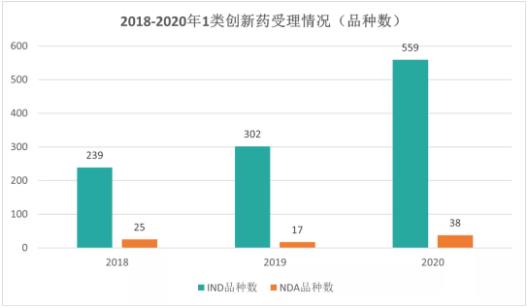
2018年
药审中心受理1类创新药临床试验(IND)申请为239个品种;受理1类创新药新药上市申请(NDA)25个。IND中,抗肿瘤药、消化系统药物、内分泌系统药物和抗感染药物较多,占全部创新药临床试验批准数量的68%。
获批新药25个,1类创新药以抗癌药居多,共有8个,以大适应症为主,如非小细胞肺癌治疗药物共有3个,它们是盐酸安罗替尼、盐酸阿来替尼和纳武利尤单抗;治疗黑色素瘤的药物共有2个,它们是特瑞普利单抗、帕博利珠单抗。值得一提的是,特瑞普利单抗是君实生物研发的我国首个国产PD-1抗体,该药基于一项单臂临床试验的客观缓解率结果给予有条件批准。据君实生物CEO李宁博士介绍,该药从报临床试验到上市历时约4年,显示出了药审中心与企业紧密的沟通交流与合作。
其余获批新药包括晚期结直肠癌药物呋喹替尼、乳腺癌药物马来酸吡咯替尼及霍奇金淋巴瘤药物抗PD-1单克隆抗体信迪利单抗。呋喹替尼是和记黄埔历时13年研制靶向抗癌药。结直肠癌在临床上存在巨大需求,小分子替尼类药物与PD-1单抗各占据一半。其他创新药包括抗感染药5个、其中3个是抗丙肝药。
2019年
受理1类创新药IND为302个品种,较2018年增长26.4%;受理1类创新药NDA 17个品种,较2018年减少了8个品种。药审中心批准IND的创新药中,依然是抗肿瘤药、消化系统疾病药、抗感染药和神经系统疾病药较多,占全部创新药临床试验批准数量的70%。
我们再来看2019年获批的17个新药。抗肿瘤药依然最多,共有7个,有两个生物类似药,分别是利妥昔单抗和贝伐珠单抗。还有CD38抗体、IgG2抗体等大分子药物达雷妥尤单抗和地舒单抗。一些小分子抗肿瘤药也大放异彩,包括Bcr-abl酪氨酸激酶抑制剂甲磺酸氟马替尼及用于非小细胞肺癌患者一线治疗的小分子表皮生长因子受体(EGFR)酪氨酸激酶抑制剂(TKI)达可替尼。
此外,甲苯磺酸尼拉帕利作为PARP抑制剂创新药,用于治疗复发性上皮性卵巢癌、输卵管癌或原发性腹膜癌成人患者。PARP抑制剂在国内逐渐热门。据中国医药创新促进会(PhIRDA)抗肿瘤药物临床研究专业委员会发布的《2020年度中国抗肿瘤新药临床研究评述》,截至2020年,中国已有4个PARP抑制剂获批,8项临床试验正在进行。
2019年其他获批抗感染药有4个、循环系统药物1个,风湿性疾病及免疫药物有2个。其中,贝利尤单抗是全球近60年来首个上市治疗系统性红斑狼疮(SLE)的新药。神经系统药物咪达唑仑为国内首款治疗儿童惊厥急性发作的口颊粘膜溶液。随着药审中心鼓励儿童用药临床开发指南的出台,我国儿童用药研发企业的热情或将被激活。皮肤及五官科治疗药物本维莫德也一鸣惊人,该药有全新结构和全新作用机制,适用于治疗成人轻至中度稳定性寻常型银屑病。该药主要发明人陈庚辉博士说,从发现到上市经历二十年,实属不易。
此外,2019年,药审中心有4个罕见病药物通过临床急需境外新药名单及我国第一批罕见病目录等途径获批,它们是依洛硫酸酯酶α、注射用阿加糖酶β、诺西那生钠以及依达拉奉氯化钠,解决了相应疾病治疗领域里尚无有效治疗手段的问题。
2020年
药审中心首次将2020年发布的技术指导原则、境外已上市临床急需新药审评审批情况获批的创新药物、临床试验阶段纳入突破性治疗通道的药物情况、审评通过的创新药、审评通过的境外生产原研药、已批准上市药品纳入加快上市程序情况进行了梳理。
受理1类创新药注册申请共597个品种,较2019年增长51.71%。其中,受理IND申请559个品种,较2019年增长49.78%;受理NDA 38个品种,较2019年增长100.00%。以药品类别统计,中药、化学药、生物制品1类创新药受理量分别为14、752、296件。
在创新药审批上,2020年,药审中心批准的新冠病毒疫苗和新冠肺炎治疗药物共有3个。
抗肿瘤领域获批药物包括阿美替尼、抗血管生成口服小分子酪氨酸激酶抑制剂索凡替尼、全球首个CD30靶点以及国内首个用于恶性淋巴瘤患者的ADC药物注射用维布妥昔单抗、全球首个靶向CD3和CD19靶点的双特异性抗体贝林妥欧单抗是我国首个用于急性淋巴细胞白血病的双特异性抗体、国内首个用于放射性碘难治性分化型甲状腺癌的小分子药物酪氨酸激酶抑制剂仑伐替尼。
此外,还获批了2个抗感染药,2个循环系统药物,2个呼吸系统药物,2个神经系统药物,2个罕见病药物等。
2020年虽经历了新冠疫情,但新药研发审评数量没有减少,审评时限也没有压缩,且获批上市数量明显大于过去3年同期水平,并达到近年最高水平。国内以恒瑞医药、百济神州、和黄医药、再鼎医药,正大天晴,石药集团、东阳光为首的诸多企业申报成果显著,正大天晴、东阳光药均有超过5个品种首次申报IND。
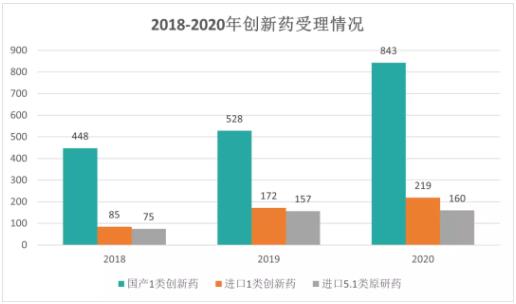
从上图中看出,新《药品注册管理办法》出台以后,境外已上市境内未上市的5.1类原研药申报也有增长。除了1类创新药,2018年药审中心受理的5.1类化药进口原研药注册申请为75件,到了2020年,5.1类化药为160件。
对于5.1类首次进行申报的境外已上市境内未上市的新药,基于ICH指南,以种族差异性分析和桥接试验证据链来整体考量在中国人群的获益风险评估。这将吸引境外罕见病或严重危及生命疾病、且无有效治疗手段的疾病的药品以附条件批准上市进入中国。5.1类药在中国也迎来申报和临床研究的新机遇。
正如药审中心化药临床一部部长杨志敏最近在CSCO大会上总结所说,2018~2020年IND注册申请数量逐年增多,特别是2018年7月27日IND审评执行默示许可(60个工作日)之后,增幅明显。其中肿瘤药IND申请数量约占整体IND申请数量一半。
由上述三年的新药获批情况来看,化学药依然是我国药物研发生产的主要途径。截至2020年底,我国化学药品制剂生产企业达到1123家。
生物制品近年来也快速增长,从2018年的971件申请数量增长至1410件,以抗肿瘤药为例,据杨志敏在CSCO大会上介绍,我国抗肿瘤药研发的活跃程度占全球比例增高,中国加入全球早期研究和关键研究的数量增加,中国制药企业开展MRCT数量也在增加,最终,近两年抗肿瘤新药获批数量增加。
2021年上半年,肿瘤药获批数量依然占据大头,据CDE最新统计数据,截至到2021年9月10日,共有45种新的肿瘤适应症获批。

来源|第24届全国临床肿瘤学大会暨2021年CSCO学术年会线上会议
大分子申报增幅明显高于小分子化合物,单抗、双抗、多抗、ADC、治疗性疫苗、溶瘤病毒、细胞治疗为主要申报方向。
这一切与我国药品审批审评制度的改变和行业生态环境的构建息息相关。国家药监局药审中心主任孔繁圃在接受《医药经济报》采访时说,近年来,药品审评审批把有限的审评资源用在具有明显临床价值的创新药和急需药上,经过近几年的实践和优化,这些改革措施已逐步显效。
2. 审评质量变化
2018年药审中心实现中药、化药、生物制品各类注册申请按时限审评审批率已超过90%,基本完成了国务院《关于改革药品医疗器械审评审批制度的意见》(44号文件)确定2018年实现按时限审批的工作目标。
2018年底排队等待审评审批的注册申请由2015年9月高峰的近22.000件降至3440件,解决了注册申请积压。全年按时限审批完成率为84%。
2019年药审中心实现了中药、化学药、生物制品各类注册申请按时限审评审批率超过99.8%,完成了44号文件确定的工作目标。
2020年 药审中心全年申请任务完成率为94.48%,其中临床急需境外已上市新药注册申请审结任务完成率为100%,按默示许可任务按时限完成率为99.87%。
2020年NDA年度整体按时限完成率大幅提升,如:NDA按时限完成率在2020年12月突破80%,提升至87.5%;纳入优先审评程序的申请按时限完成率达90%以上,取得突破。
2018~2020年,药审中心通过加大审评通道、强化项目管理、招聘人员等方式,扩增了审评力量、提高审评效率和速度,令药品注册申请积压得以解决。
研发客了解到,这几年间,药审中心建立了以临床疗效为核心,规范指南在前指导、审评过程中保持沟通交流、最后是审评决策的审评管理流程,比如,审评项目按专业、适应症分配;经受理形式审查之后,进入参审和主审专业审评阶段,最后是三个专业综合审评,各级审评员职责清晰,跨专业审评组互相配合。
药审中心全体人员编制从2015年190人增至2021年7月的648人,其中,审评员达到435人。尤其是众多具有工业界研发背景的人才加入,带来了制药人员的视角,促进了药审中心与申请人之间的交流。
在申报环节,药审中心引导申请人科学、规范、理性地从临床角度申报项目,充分准备申请材料,直到立项、开展临床试验,节约了不必要的沟通交流、发补。
尤其值得一提的是,药审中心于2021年初发布了《药品审评审批信息公开管理办法》,目的是提高药品审评审批工作的透明度,可以看出药监部门提高审评审批工作质量的努力和态度。
3.沟通交流优化审评流程
近年来,药审中心持续加强和企业的沟通交流。据CDE相关老师介绍,在我国申报,所有沟通交流都均为免费。
从2018~2020年,药审中心不管是接受、办理亦或是技术问题的咨询都保持增长,企业一般性技术问题咨询总件数从15.219件增长至20.285件。申请人和药审中心的紧密交流不仅能帮助药企解决申请中的科学相关难题,还令CDE在地反馈中优化评审流程,订正评审不合理的地方,促进企业和药审中心共同成长。
新药审评的成绩和挑战
过去三年,药审中心通过加快境外已上市临床急需新药审评,落实临床试验默示许可制,进一步细化优先审评、沟通交流、立卷审查制度,推进改革临床试验管理等措施,把药品审评工作做得更细致、专业。而国家药监局在加入ICH后也在不断转化实施各项指南。
药审中心在追求创新的路上,依然没有止步。据了解,2020年,药审中心起草了119个技术指导原则,正式发布了71个。在此基础上,2021年上半年发布了37个技术指导原则。2021年全年计划制定102个,覆盖新冠肺炎防治药品、中药、化学药、生物制品、儿童用药等多个领域,目前均全部启动,其中征求意见12个,已完成公开征求意见24个,已报送国家药监局审查12个,经国家药监局审查同意即将发布2个。
眼下,中国新药审评又将面临哪些挑战呢?
笔者曾在北京市朝阳区建国路128号北京的药审中心一层大楼大厅的墙壁上,看到上面写着药审中心的使命是——保护和促进公众健康,这与美国FDA的使命同出一辙。我们不要忘了,CDE的核心职责是负责药物临床试验、药品上市许可申请的受理和技术审评,承担国家药监局宣传落实ICH相关技术工作等。在中国快速迭代的创新药研发时代,面对数量巨大的申请任务,中心首先需要权衡的无疑是药品审评的质量与速度。
根据药审中心年报,2020年是《药品注册管理办法》实施以后,7月一个月就受理了43个新药,其中一类化药共计21个品种。这反映出创新药研发的速度和效率之高,是中国制药历史上从未有过的。又快又好审评好药的背后,是药审中心团队日积月累的审评能力的体现、也是鼓励创新的机制体制的支撑。
需要警醒的是,过于强调新药审批速度,忽略掉审批过程中的必要环节和步骤,无疑很可能导致质量不佳的药物流入市场;然而在审评过程中如果趋于保守,很可能导致新药评审严重滞后。药物安全与创新疗效如影随形,不停博弈。如何在不降低质量的情况下,减少药物在注册审批上耗费的时间?这在全球药监机构都是两难的命题。
到底应如何应对呢?笔者看来,药审中心仍需以患者需求为中心,谨记保护和促进公众健康为己任,开展科学规范的审评(Good Review Practice),将有限的审评资源集中在“刀刃”上,满足患临床急需,综合多方面意见,对药企进行有效指导,在交流中产生科学的审评智慧,才是破局之道。此外,所有法规和技术指南如何制定的科学、规范、有序,以科学监管为宗旨,让其具有可预见性、持续性和稳定性,也是国家药监局和CDE需要思考的课题。
我们衷心希望,中国的生物制药企业能继续保持创新的动力,希望药审中心未来发挥技术评审力量,对好药进行及时有效审评。最后,借用原药审中心主任、沈阳亦弘商学院院长张象麟女士曾说过的一句话——相信中国药监,相信中国药审中心,因为药审中心就是中国药监的未来。

 产业资讯
产业资讯
 医药魔方Pro
医药魔方Pro  2025-06-02
2025-06-02
 55
55

 产业资讯
产业资讯
 UTgene
UTgene  2025-06-02
2025-06-02
 55
55
 产业资讯
产业资讯
 药精通Bio
药精通Bio  2025-06-02
2025-06-02
 54
54