 产业资讯
产业资讯
 凯莱英药闻
凯莱英药闻  2021-12-03
2021-12-03
 3209
3209
11月30日,艾博维宣布,已向EMA提交了Risankizumab(600mg规格静脉注射诱导疗法及360mg规格皮下注射维持疗法)第三个适应症补充上市申请,用于治疗16岁及以上对常规疗法或生物疗法应答不足、失去应答或不耐受的中度至重度活动性克罗恩病(CD)患者。该申请基于三项3期临床试验ADVANCE、MOTIVATE及FORTIFY。
ADVANCE和MOTIVATE研究是3期、随机、双盲、安慰剂对照的诱导研究,旨在评估两种静脉注射剂量的Risankizumab(600 mg和1200 mg)在中重度克罗恩病成人中的疗效和安全性。两个试验中Risankizumab均达到第12周临床缓解和内窥镜应答的主要终点。
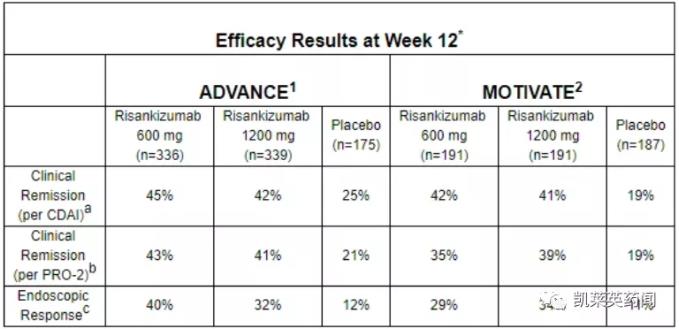
在FORTIFY研究中,评估了对Risankizumab静脉注射诱导治疗产生临床应答的克罗恩病患者接受维持疗法的疗效和安全性,与停用Risankizumab的患者相比,接受360mg皮下注射Risankizumab治疗的患者在一年(52周)内达到内镜应答和临床缓解的比例显著增加。
ADVANCE、MOTIVATE及FORTIFY研究中,均未观察到新的安全性风险。
Risankizumab首次获批时间为2019年4月,已获FDA和EMA批准的两项适应症分别为银屑病性关节炎和斑块状银屑病。Skyrizi上市首年大卖3.55亿美元,第二年销量达到15.9亿美元,2021年前3季度全球销售额达到20.44亿美元,全年销售额将接近30亿美元。
Risankizumab是靶向IL-23A的人源化IgG1单抗,能够选择性的结合IL-23的p19亚基结合并抑制IL-23与其受体的相互作用,从而阻断IL-23刺激Th17细胞亚群诱导其产生IL-17A与IL-17F等细胞因子,抑制炎症发生。
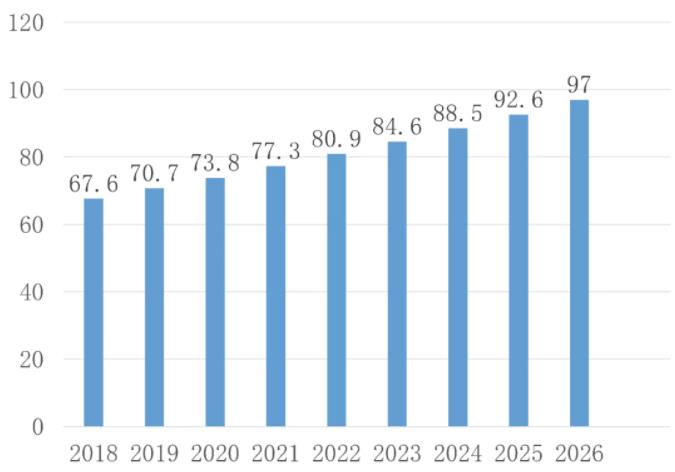
该药CD适应症的补充上市申请已于2021年9月向FDA提交。CD可累及全消化道,为非连续性全层炎症,最常累及部位为末端回肠、结肠和肛周。确切的发病原因尚不清楚。Global Data给出CD市场规模预测,到2026年CD药物治疗市场将达到134亿美元,年复合增长率3.8%,如下图所示(单位:亿美元)。

 产业资讯
产业资讯
 医药观澜
医药观澜  2025-12-16
2025-12-16
 18
18

 产业资讯
产业资讯
 药智网
药智网  2025-12-16
2025-12-16
 17
17

 产业资讯
产业资讯
 财经大健康
财经大健康  2025-12-16
2025-12-16
 16
16