 产业资讯
产业资讯
 米内网
米内网  2021-12-08
2021-12-08
 3115
3115
根据美国食品和药物管理局(FDA)的数据统计,11月FDA共批准了4款创新药物,包括3款新分子实体和1款生物药。2021年前11个月,美国FDA已陆续批准了46款创新药物,其中35款为新分子实体,11款为新生物制品。2021年FDA批准的创新药物总数量能否冲入近十年FDA批准的创新药物数量的前三甲位置,实属让人期待。
近十年FDA批准的新药数量

来源:FDA网站、公开资料
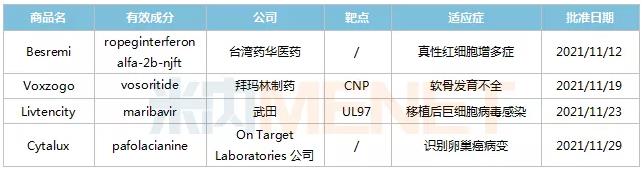
2021年11月,美国FDA共批准4款创新药物,分别为治疗真性红细胞增多症的Besremi(ropeginterferon alfa-2b-njft);治疗伴有开放性生长板的软骨发育不全儿童患者的Voxzogo(vosoritide);治疗接受造血干细胞移植(HSCT)或实体器官移植(SOT)后,难治性巨细胞病毒感染的Livtencity(maribavir);以及作为辅助手段在卵巢癌手术中识别恶性病变的靶向荧光显像剂Cytalux(pafolacianine)。
11月获批的创新药物有一个共同点:都获得美国FDA授予的孤儿药资格。孤儿药即罕见药,是指用于预防、治疗、诊断罕见病的药品,因罕见病患者数量少,药品市场小、研发成本高、难度大,众多罕见病患者面临无药可用的局面。为了鼓励开发用于治疗罕见病的创新药物,美国1983年颁布《孤儿药法案》,建立了较为系统的孤儿药研发激励制度。根据《孤儿药法案》,凡获得孤儿药资格认定的新药,有机会获得7年市场独占权,此外还享有税费优惠、快速审批通道等一系列配套措施。近年,随着各种孤儿药的利好政策的出现,无论是在全球范围还是在国内,孤儿药的关注度都得到很大的提升。
11月FDA批准新药的详细信息
来源:FDA网站、米内网全球药物研发库
Besremi(ropeginterferon alfa-2b-njft)
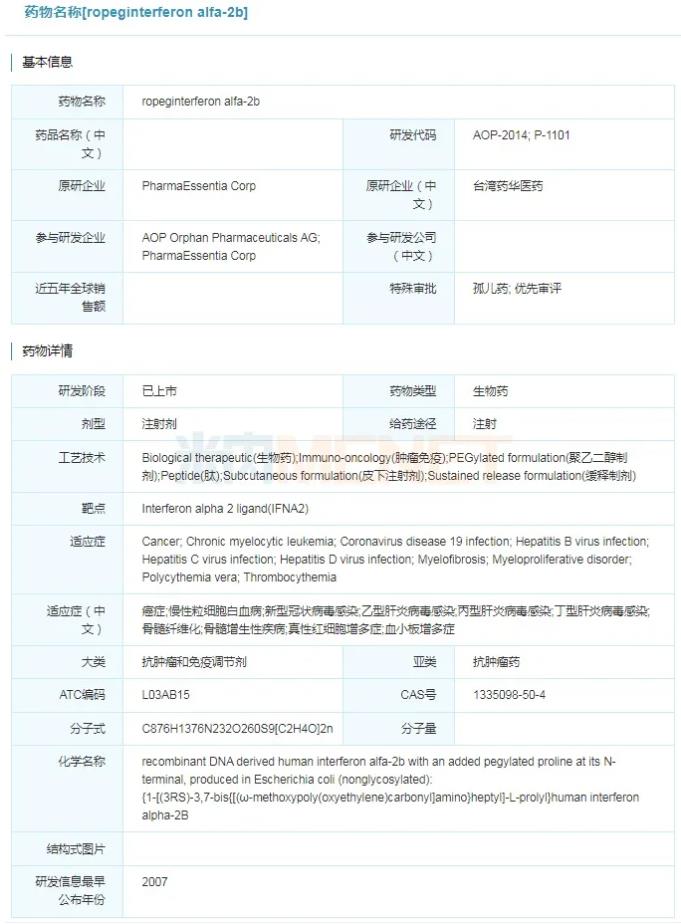
2021年11月12日,美国FDA批准台湾药华医药的Besremi(ropeginterferon alfa-2b-njft)上市,用于治疗真性红细胞增多症(PV)的成人患者。Besremi是首款获得FDA批准的真性红细胞增多症治疗药物,也是首款专门批准用于真性红细胞增多症的干扰素疗法。2019年2月26日,Besremi在欧盟获得全球首次批准,用于治疗不存在症状性脾肿大的真性红细胞增多症成人患者。此外,Besremi还获得了中国台湾、瑞士、以色列及韩国的上市许可。
ropeginterferon alfa-2b具体信息
来源:米内网全球药物研发库
真性红细胞增多症(PV)是骨髓增生性肿瘤的一种,为罕见的早期血癌。这种血液病会导致红细胞生成过多,过量的细胞使得血液变粘稠、血流速度减慢,从而增加血栓的机会,容易引发一系列的心血管并发症。在美国,每年大约有6200人确诊患有真性红细胞增多症。
Besremi治疗真性红细胞增多症的安全性和有效性在名为PEGINVERA和PROUD/CONTINUATION-PV的试验中得到了验证。在PEGINVERA试验中,有51例平均接受Besremi治疗约5年的真性红细胞增多症患者参与此试验。Besremi的疗效通过观察实现完全血液学应答的患者比例来评估。完全血液学应答意味着在没有接受近期放血术的情况下患者红细胞体积小于45%、白细胞计数和血小板计数正常、脾脏大小正常,没有发生血栓。总的来说,61%的患者接受Besremi治疗经历了完全血液学应答,80%的患者达到了血液学应答。
Voxzogo(vosoritide)
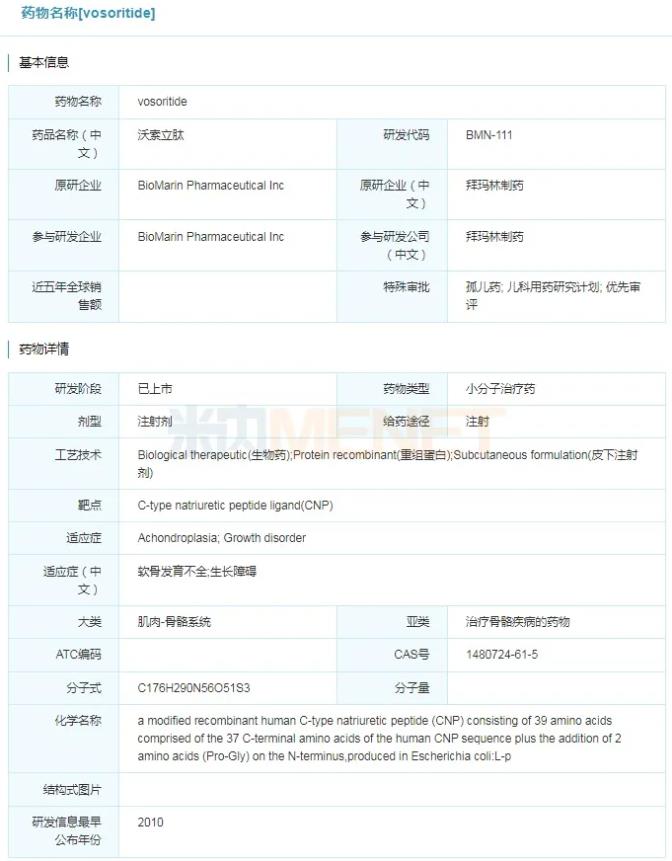
2021年11月19日,拜玛林制药公司宣布,美国FDA已加速批准Voxzogo(vosoritide)上市,用于治疗5岁及以上伴有开放性生长板的软骨发育不全的儿童患者,促进其线性生长。Voxzogo是首款获得FDA批准用于治疗软骨发育不全的儿科药物,可从根本病因上治疗软骨发育不全。此前,Voxzogo还获得FDA授予的孤儿药和优先审评的资格认定。2021年8月26日,Voxzogo在欧盟获得全球首次批准,用于年龄从2岁至生长板闭合的儿童治疗软骨发育不全症。
vosoritide具体信息
来源:米内网全球药物研发库
软骨发育不全是一种导致身材严重矮小和发育不均衡的遗传疾病,由FGFR3基因突变引起。FGFR3是一种骨骼生长的负向调节剂,该基因突变会抑制患者生长板软骨细胞的增殖、分化,导致长骨生长障碍,儿童因此生长变慢。成年患者的平均身高仅为1.2米左右。在美国,有10000多名患有软骨发育不全的儿童的医疗需求未得到满足。Vosoritide通过抑制过度活跃的FGFR3通路,并且刺激生长板软骨细胞增殖、分化,促进软骨内骨形成,从而根本上帮助患者恢复正常生长。
此次批准主要基于一项为期一年、双盲、安慰剂对照的3期临床研究,该研究纳入了121名5至14.9岁具有开放性生长板的软骨发育不全的儿童患者。在研究中,患者随机接受 Voxzogo治疗或安慰剂。在治疗第52周后,安慰剂组年化增长速度(AGV)与基线相比的变化为-0.17cm/年,Voxzogo治疗组AGV与基线相比的变化为1.40cm/年。总的来说,与安慰剂组相比,Voxzogo治疗组的AGV在统计学上显著改善1.57cm/年。
Livtencity(maribavir)
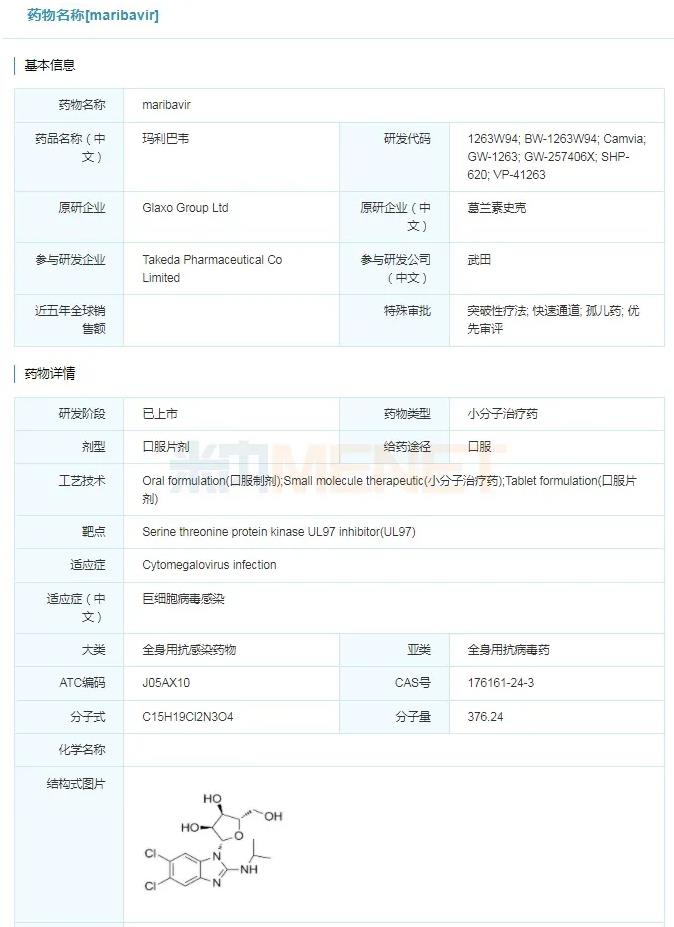
2021年11月23日,美国FDA批准武田制药的Livtencity(maribavir)上市,用于治疗接受造血干细胞移植(HSCT)或实体器官移植(SOT)后,感染难治性巨细胞病毒(CMV)的成人或12岁以上儿童患者。Livtencity是美国FDA批准的首款也是唯一一款用于治疗对常规抗病毒疗法不产生应答、移植后巨细胞病毒感染的药物。此前,Livtencity还获得了FDA授予的孤儿药、优先审评和突破性疗法等资格认定。
maribavir具体信息
来源:米内网全球药物研发库
巨细胞病毒(CMV)是一种β-疱疹病毒,通常在干细胞或器官移植后引起患者感染。在造血干细胞移植患者中的发生率约为30~70%,在实体器官移植患者中的发生率约为16~56%。CMV感染可导致CMV疾病并对移植受者造成一系列直接或间接的严重伤害,包括移植器官的丧失和死亡,严重威胁患者的生命。
Livtencity的安全性和有效性在一项多中心、开放标签、活性对照的3期临床试验中得到验证。352名受到CMV感染的患者随机分为治疗组或活性对照组,治疗组患者接受Livtencity治疗,活性对照组接受更昔洛韦、缬更昔洛韦、膦甲酸和西多福韦中一种或两种药物治疗。研究第八周后,治疗组的235名患者中,56%患者CMV的DNA水平低于可测量值,而在活性对照组的117名患者中,这一比例仅为24%。
Cytalux(pafolacianine)
2021年11月29日,美国FDA宣布,批准On Target Laboratories公司的靶向荧光显像剂Cytalux(pafolacianine)上市,用于作为一种辅助手段,在卵巢癌手术中识别恶性病变,从而让医生能够为卵巢癌成年患者切除更多肿瘤。此前,Cytalux还获得了FDA授予的孤儿药、优先审评和快速通道等资格认定。
pafolacianine具体信息

来源:米内网全球药物研发库
卵巢癌已成为所有女性生殖系统癌症中最致命的一种癌种。根据美国癌症协会数据,2021年将有超过21000例卵巢癌新病例,估计有13000多人死于该疾病。卵巢癌的常规治疗除了化疗阻止恶性细胞的生长、其他靶向治疗来识别和攻击特定的癌细胞,还有的就是手术切除尽可能多的肿瘤。由于卵巢癌通常会导致身体在细胞膜中过度产生一种称为叶酸受体的特定蛋白质,术前注射Cytalux后,Cytalux与这些蛋白质结合并在荧光灯下发光,可以提高外科医生识别癌组织的能力。
Cytalux的安全性和有效性在一项随机、多中心、开放标签的3期临床研究中得到评估。该研究针对诊断为卵巢癌或临床高度怀疑卵巢癌并计划接受手术的女性,134名年龄在31~81岁的女性患者参与此项研究。注射Cytalux后,手术期间医生分别在正常光和荧光灯下识别癌性病变。结果显示,26.9%的女性至少检测到一个标准视觉或触觉检查未观察到的癌性病变。

 产业资讯
产业资讯
 医药观澜
医药观澜  2025-12-16
2025-12-16
 42
42

 产业资讯
产业资讯
 药智网
药智网  2025-12-16
2025-12-16
 35
35

 产业资讯
产业资讯
 财经大健康
财经大健康  2025-12-16
2025-12-16
 33
33