 产业资讯
产业资讯
 研发客
研发客  2022-01-11
2022-01-11
 2391
2391
在2021年中国获批的新药中,有三款产品最受注目:两款CAR-T——阿基仑赛和瑞基奥仑赛,一款ADC产品——维迪西妥单抗。
之所以单独讨论这三款产品,是因为他们都代表了前沿领域在中国市场的突破。
一方面是细胞治疗产品首次在中国上市。细胞治疗与传统的大分子、小分子药物存在较大的差异,这种差异和前沿领域本身居高不下的热度让他们的研发和审批过程非常值得跟踪与拆解,不仅启示这类产品开发的着眼点,还展示了药监在这一领域监管体系逐步完善的进程。
另一方面,维迪西妥单抗代表首个本土研发的ADC药物获批上市,这一前沿、热门的药物开发领域中,本土创新将上演什么样的竞争场景同样引发关注。
实战背后的细胞治疗监管体系进化
国内获批的两款细胞治疗产品均是靶向CD19的自体CAR-T,来自国际知名细胞治疗公司的技术引进或改进,有先天的大企业背书。
中国此前没有细胞治疗产品通过药品审批途径上市应用,细胞治疗跟其他药品的属性又有较大差异,因此,这两款产品在国内的审批上市过程可以说最受关注。
复星凯特在2020年2月递交阿基仑赛NDA,2021年6月正式上市;药明巨诺在2020年6月递交瑞基奥仑赛NDA,2021年9月上市。相较他们预计的上市时间,均有一定程度延迟。
阿基仑赛作为中国首个上市的CAR-T,在1月完成了所有审批,又经过了长达5个月的反复讨论才最终上市。可见,对于这一全新疗法如何保证安全性,进入市场后如何规范其应用,药监机构是慎之又慎的。
2021年研发客临床年会上公开了这两个产品审批过程的一些信息。审批的焦点不仅包括有效性和安全性风险,还考虑到两款细胞治疗产品均是个体化疗法,CDE关注的点延展到药学和CMC方面,这两方面在后续审评考量中尤为突出,整个制备流程都很关注。
药监机构的重视和审慎态度体现在很多细节中:疗效和安全性结果的细致评估,与企业活跃的交流以及审查团队的高规格等。
如,阿基仑赛一共有四个临床研究中心,审批过程一开始选择两个研究中心进行核查,最后又拓展到对四个临床中心均进行了核查。在安全性和疗效的评估中,会抽取结果现场让医生重新评估和解释安全性影响因素。
在两款产品审批实战中,CDE反复摸索,深入、细节的研讨也转化成后续工作的基础,伴随产品的审批进程,CDE发布了多项法规,进一步明晰细胞治疗申报的路径和注意的事项。
据研发客不完全统计,2020~2021年两年时间里,药监局共发布了9项有关细胞治疗的法规,囊括了药学、临床前、临床研究和上市后真实世界研究等全流程(见下表)。
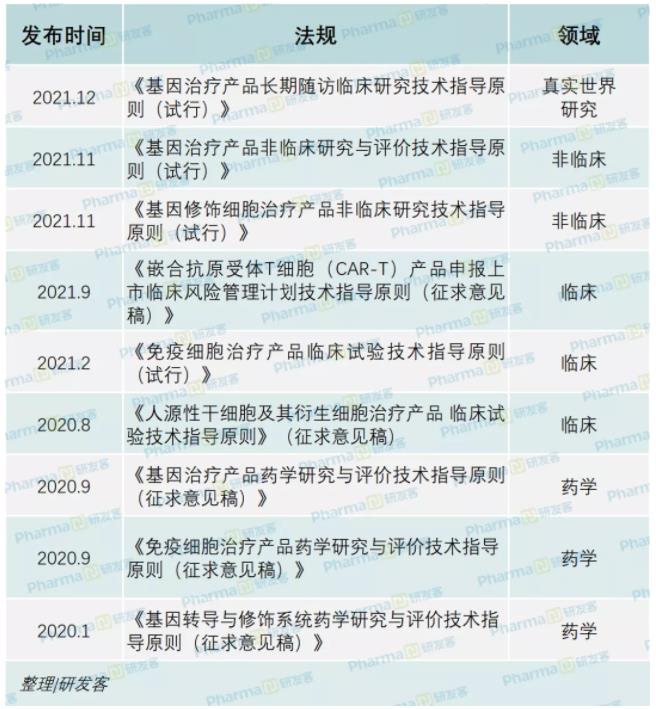
事实上,2019年,药监局启动了科学监管行动计划,首批项目就包括“细胞和基因治疗产品技术评价与监管体系研究”。完整的体系规划中,监管思路也在不断变化,有阶段性的偏重。
2021中国肿瘤免疫治疗会议上,一位CDE资深审评专家就表示:2019~2021年,CDE着眼于细胞治疗和基因治疗的监管;2021~2023年间,将转向干细胞和基因治疗、抗病毒治疗和真实世界数据的监管。
本土ADC加入竞争的策略
目前,全球已有14款ADC药物获批上市,中国上市的ADC有4款,包括维迪西妥单抗和三个进口产品——2020年1月获批的罗氏恩美曲妥珠单抗(T-DM1),2020年5月获批的武田/seagen的维布妥昔单抗,2021年12月获批的辉瑞的奥加伊妥珠单抗。
ADC领域的竞争一向比较激烈,Natrue子刊预测,到2026年,全球ADC药物市场规模将达到164亿美元。
据研发客统计,包括辉瑞、葛兰素史克、第一三共、罗氏等多家跨国公司共有10款ADC产品布局中国市场,5款进入Ⅲ期临床或NDA阶段;布局这一领域的本土药企有25家,开发产品77个,占产品总数的89%,已经成为这个领域的主力军,同样有5款产品进入Ⅲ期临床或NDA阶段。
一个领域中前三个上市产品通常被认为占据市场竞争速度上的先机,维迪西妥单抗就是这第三名,上市时间紧跟进口产品的节奏之外,更引人关注的是其创新的成色和竞争的策略。
在研发客此前对荣昌生物的采访中了解到,维迪西妥单抗立项初始对标的即T-DM1。T-DM1是全球第三个上市的ADC,2013年在美国获批。同为靶向HER2,T-DM1与维迪西妥单抗也是中国市场上比较主要的竞争对手。
T-DM1由罗氏“当家花旦”曲妥珠单抗连接微管抑制剂DM1(MCC linker);维迪西妥单抗由荣昌生物自主研发的HER2抗体(disitamab)连接微管蛋白结合剂甲基澳瑞他汀E (可被酶剪切的连接子)。与曲妥珠单抗相比,disitamab对HER2亲和力更高,这是来自生物学上的差异。
国内大部分创新药物开发通常会选择对标国际上较为成熟的产品,ADC领域也是如此,T-DM1及HER2靶点是国内多数ADC开发企业的切入点,因此这个靶点领域相对拥挤。
据研发客统计,国内已公布的ADC药物中有23款靶向HER2,占全部产品的26%。
产品适应症的选择与靶点特性相关,HER2在乳腺癌和胃癌高表达,这是靶向HER2的ADC产品两个重要的方向。而适应症上的差异化可能是维迪西妥单抗开发的重要策略。
T-DM1在国内获批治疗HER2阳性转移性乳腺癌,维迪西妥单抗首个适应症则是国内更为高发的胃癌,避开了与T-DM1的直接竞争。值得留意的是,T-DM1也曾开展针对HER2阳性胃癌的临床试验GATSBY,但这项研究的最终结果显示,T-DM1的疗效并不优于紫杉醇。
根据荣昌生物官网信息,维迪西妥单抗还在进行乳腺癌、尿路上皮癌、胆道癌和非小细胞肺癌的临床研究。其中,尿路上皮癌是产品开发另一大重点。靶向HER2治疗尿路上皮癌较为少见。
目前,NMPA已经批准了维迪西妥单抗的尿路上皮癌新适应症。在美国,该适应症的Ⅱ期临床试验正在开展,作为维迪西妥单抗在美国上市的首发适应症。在美国已经有12款ADC产品上市的格局下,尿路上皮癌可以说成为维迪西妥单抗适应症差异化最重要的发力点。
在出海的布局上,荣昌生物今年与美国生物制药公司Seagen达成开发和商业化维迪西妥单抗的全球独家许可协议,这项license-out交易总额高达26亿美元,创下了纪录。Seagen本身以ADC药物研发为主,为维迪西妥单抗后续国际市场的推动奠定了基础。
另外,维迪西妥单抗在今年被纳入了国家医保目录,T-DM1目前还没有进入国家医保,这对后续放量可能带来一定程度影响。

 产业资讯
产业资讯
 药融圈
药融圈  2025-07-07
2025-07-07
 68
68

 产业资讯
产业资讯
 医药魔方Pro
医药魔方Pro  2025-07-07
2025-07-07
 74
74

 产业资讯
产业资讯
 药研网
药研网  2025-07-07
2025-07-07
 74
74