 产业资讯
产业资讯
 研发客
研发客  2022-05-06
2022-05-06
 3323
3323
复盘三年以来全球和中国新冠药物开发,还有哪些需要完善之处?当GCP遇上疫情,我们如何加快推进新冠药物的临床研究?
在5月1日观合医药组织的线上“新冠药物研发沙龙”上,大家一致认为,为了实现科技抗疫,国家科研资金应更多向组织执行力强的科研单位和生物制药企业倾斜;而学术机构、监管机构、医疗机构、企业等应该全国一盘棋推动基础科研和临床研究,这是全面提升我国新冠药物研发效率的有效手段,与此同时,如何在新冠药物评审上找到一种“降低病毒载量”和“减轻症状”之间的平衡,或许是下一步中国新冠口服药诞生的关键。
监管科学和方案顶层设计是关键
从全球新冠药物研发的碎片化资料收集整理中,药品监管科学研究学者、中国药科大学杨劲教授回顾了几款主要品种的作用机制、临床试验设计及审评结果。其中包括最初吉利德的瑞德西韦、老药羟氯奎/氯奎、礼来的巴瑞替尼,再到开拓药业的普克鲁胺、默沙东的Molnupiravir,腾盛博药的安巴韦单抗注射及罗米司韦单抗注射液以及辉瑞的Paxlovid(Nirmatrelvir/Ritonavir)等。

中国药科大学杨劲教授
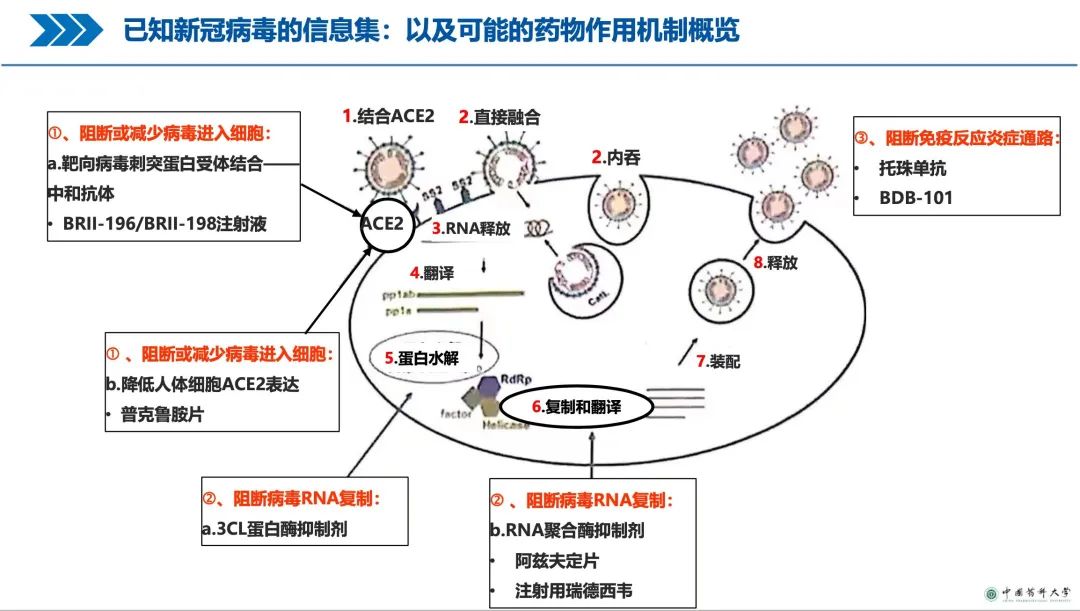
全球已有抗新冠药物及可能的药物作用机制概览
说到中国研发抗新冠药物的成就,不得不提及NMPA2021年12月8日应急批准上市的由清华大学医学院团队、深圳第三人民医院以及腾盛华创医药技术公司联合研发的具有自主知识产权的中和抗体联合治疗药物安巴韦单抗注射液(BRII-196)及罗米司韦单抗注射液(BRII-198),以及在2022年2月11日附条件批准的辉瑞的Paxlovid。
有学者认为,NMPA按统一指挥、早期介入、快速高效、科学审批的原则,全过程研审联动,滚动提交研发材料,随交随审随评,充分体现了NMPA对抗新冠药物研发的鼓励和支持。

在与新冠病毒赛跑过程中,有更多国产小分子口服药投入研发中。杨劲教授认为,口服新冠药物是终结疫情恐惧的最后一环。
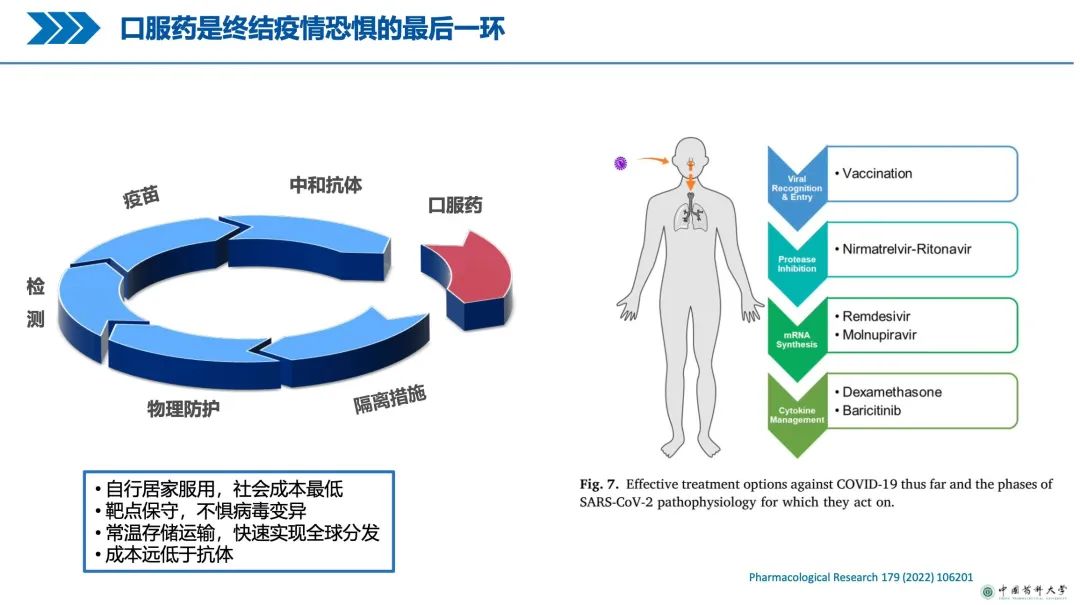
2022年4月6日,上海科技大学免疫化学研究所研究员杨海涛与清华大学教授、上海科技大学免疫化学研究所特聘教授、中国科学院院士饶子和团队在《美国科学院院刊》(PNAS)上在线发表题为Structural basis for replicase polyprotein cleavageand substrate specificity of main protease from SARS-CoV-2 的研究论文。文章报道了新型冠状病毒的关键药靶——主蛋白酶在静息态、结合底物中间态状和切割后状态的高分辨率晶体结构。与会专家认为,这些新发现为今后设计更高效的小分子抗新冠药物奠定了重要的结构基础。
目前,国产药物在研发上频繁有进展传来(见下表)。复盘新冠药物的研发和审评历程后,杨劲教授提出有几个核心问题值得关注。
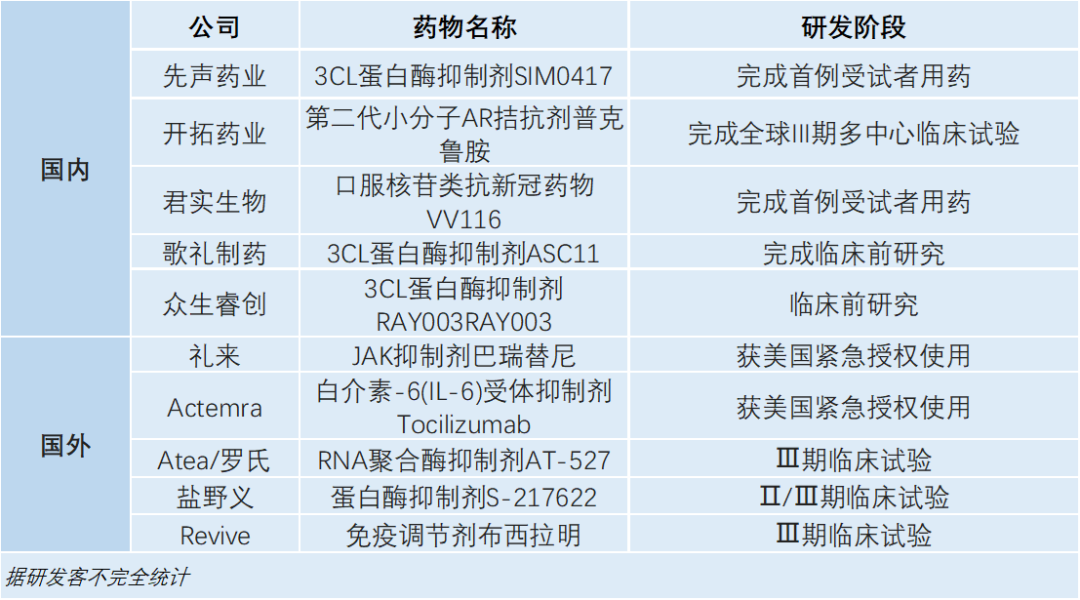
首先,是研发层面上,要考虑靶点的选择是否合适,分子成药性如何,如何优化CMC,如何快速判断有效剂量、预测病毒清除率,如何依据II期临床的指标准确预判III期临床样本量,生物标记物如何选择,最后是上市后的风险控制。这些问题决定了新冠药物临床能否获得成功。
“新冠药物临床前研究的问题较多。一些药物在体外被证明了活性,但一旦上人体,特别是早期病例数不多的情况下,仍显示出较大安全问题,需要做更全面评估。”他说。
第二,要积极应对监管方面的挑战。各国监管机构在突发重大公共卫生事件面前,灵活、科学地制定了各种鼓励抗新冠药物的研发政策,充分全面参与科研院所、制药工业界、临床研究中心的沟通交流。但同时,全球监管机构如何联动合作,实现临床试验数据互认与共享,是各国监管机构今后需要重点考虑的问题。作为药品研发者,也要提前明确药品的定位是治疗还是暴露和预防,是减少住院或死亡事件发生还是应对新的突变。同时要做好国外人群的桥接研究,把握好应急批准和EUA。
第三,提高中国新冠药物的研发效率,需要国家制定整体统筹计划,科研、制药工业、政府、医院携手才能实现。
如何快速入组患者和Follow GCP?
上海交通大学医学院附属同仁医院感染肝病主任医师、药物临床试验机构办公室主任张琴教授用自己的上海抗疫经验,分享了上海同仁医院在艰难的情况下,如何在方舱医院开展新冠药物临床试验。

同仁医院感染肝病主任医师张琴教授
截止到5月1日,国内新增确诊病例有16,121例,现有确诊病例387,136例,累计确诊病例为663,222例。目前在上海开展新冠药物的临床试验有大量的病人资源。然而,突发传染病临床研究非常艰巨,首先要快速找到传染病源,第二要切断传播环境,第三,寻找有效药物和疫苗应对,跟病毒赛跑。
张琴主任说:“临床研究中心的工作一方面是方案审查,重点从传染病的专业角度出发,严格遵循GCP,审查新冠抗病毒临床试验方案的终点指标、安全性和方案的可行性;另外,协调组织研究者进行分工、规范试验方案,同时快速筛选受试者、签知情同意书、药物发放回收及样本处理等。”
“我们在方舱医院开展了一些创新新冠药的临床研究。同仁医院院领导和伦理委员会高度重视新冠疫情期间的临床试验,应对突发情况采取了紧急的线上伦理和方案修正绿色通道,快速和有力地推动了试验项目进行。”张琴主任说。
同仁医院在实施临床试验时,协调组织了研究者进行分工、规范试验方案,同时根据国家药监局药审中心(CDE)在2021年9月3日发布的《新型冠状病毒肺炎抗病毒治疗及预防新药临床试验技术指导原则(试行)》(征求意见稿),强调对受试者安全保护及强化药物临床试验信息及时报告和风险评估。
当把方案梳理清晰后交给方舱医院的研究者,在具体协调组织研究者进行分工时候,还需要有多学科团队,包括:感染科、心内科、呼吸科、内分泌科、神经内科等,还有专业的临床试验团队、专职研究护士以及驻院CRC,开展培训,快速开展远程伦理审查。
“研究者没有太多时间看方案,我们会非常简要的把方案的重点画出来。”张主任说。同时还设计了8个相关的舱内快速筛选指引,对受试者加以入排,还有精准而严格的新冠相关症状评分表。
研究者会询问受试者以后,填写该症状评分表。受试者给药第一天的症状评分需要在给药前完成,之后每日在约同一时间填写该评分表。研究者根据受试者在过去24小时自己每个症状最严重的情况进行打分。同时还要排除受试者服用a1肾上腺能素受体拮抗剂、镇痛剂、抗心绞痛药物、抗癌药、抗感染药物等使用情况。
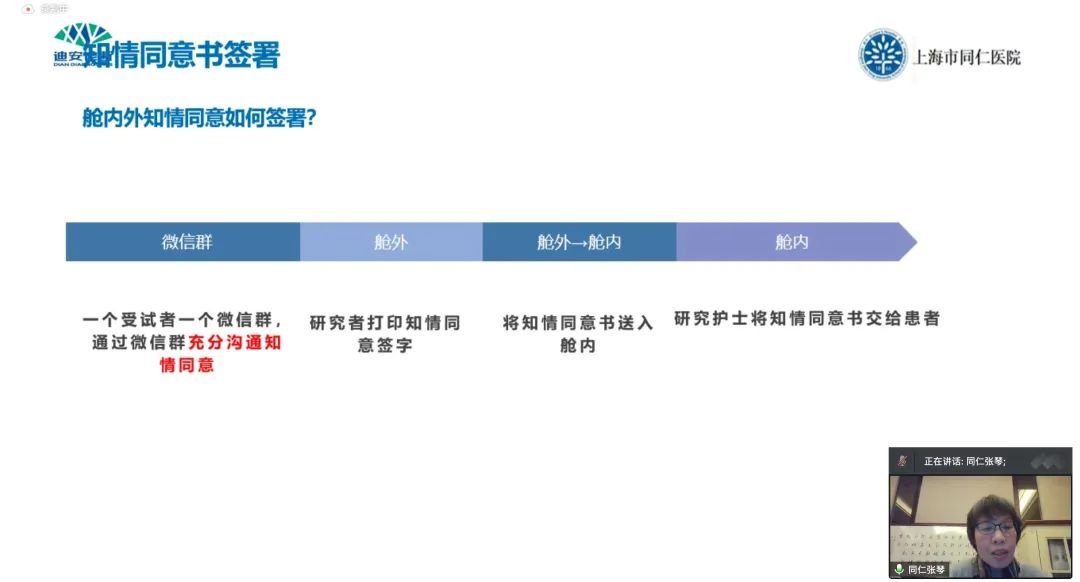
张琴主任说,在隔离病房的舱内和舱外,有两组研究者共同配合临床试验。为了严格按照试验方案筛选病人,做到精准入组,并签署知情同意书等,同仁医院对舱内/舱外的临床试验从业者进行了如下的布局。基本上都依靠微信群实现所有操作。
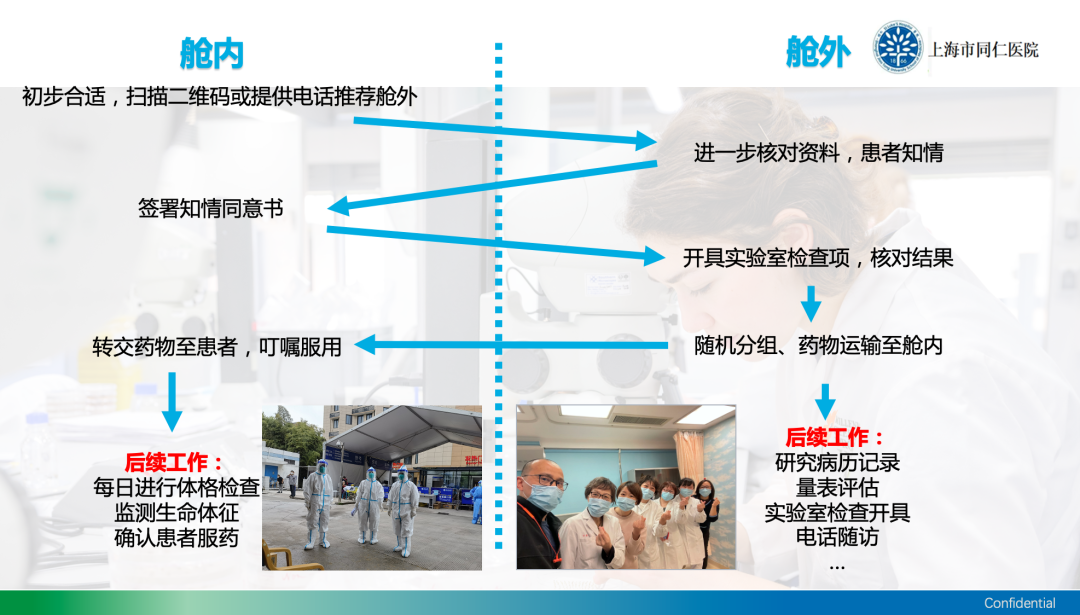
针对新冠病毒传染病,虽然没有独立的知情同意,但通过微信群,研究护士会跟每一个受试者进行全面沟通,在方舱医院里进行统一签署,做到充分知情和自愿参加和退出。
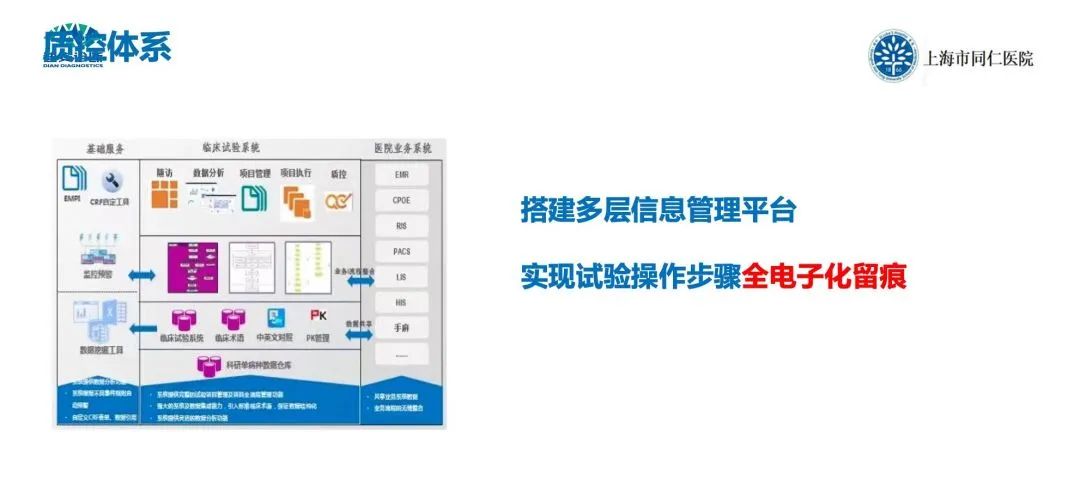
另外,在质控体系上,疫情中的试验质量控制没有任何松懈,与常态化质控一样,搭建多层信息管理平台,实现试验操作步骤全电子化留痕。同仁医院在新冠疫情期间进行全流程化管理,实现试验过程关键环节的实时质控。
在药品发放回收环节,也要经历从舱外到舱内的环节,研究护士会将药物送入舱内,监护受试者使用,回收药物时需要拍照,通过微信传递。张琴主任总结说:百年未遇的全球大流行呼吸道传染病,有很多未知和不确定因素需要研发新药和疫苗,当GCP遇到传染病,应按照指导原则制定可行性操作流程,获得真实数据;需要选择能打硬仗的研究团队是完成应急项目的首要条件。
新冠研究中心实验室的挑战
观合医药作为武汉疫情爆发时期,承接瑞德西韦临床研究的中心实验室,亲历了在抗击疫情一线进行临床研究的困难,积累了新冠临床研究经验。此次上海疫情爆发以来,我国药物临床研究各方快速响应,希望助力国产新冠治疗药物上市。观合医药作为参与方,特组织了这场线上活动。

观合医药总经理徐颐女士
观合医药总经理徐颐女士介绍,团队自2020年武汉疫情以来,参与了多项新冠药物和疫苗临床试验的中心实验室工作。她说,新冠研究和其他新药临床研究的中心实验室管理相比有很多特殊性。

比如时间的紧迫性,观合从事新冠的同事两年来从未有过节假日,365天24小时守护着样本并以最快速度获得准确的结果。如在新冠疫苗临床研究中,受试者接种疫苗后感染率过高,要仔细分析是检测相关还是当地疫情相关。新冠研究中还遇到了航班熔断,突发生的战争,各种困难都能和申办方站在一起共同解决。她还特别介绍了从项目紧急启动,到国内样本医院的政策,到检测地点灵活性,到国际样本物流挑战以及数据的解读等观合摸索的一套行之有效的新冠项目管理经验。

“最后,当看到我们的合作伙伴把观合二字放在他们发表在顶级期刊的学术研究文章里,我们非常自豪。”徐颐女士说。

深圳市第三人民医院院长卢洪洲教授深圳市第三人民医院院长卢洪洲教授主持了讨论环节。他指出,CDE在新冠疫情期间,启动了特别审评程序,研审联动,建立了快速高效的新冠疫情药物和疫苗审评审批机制,同时还出台了与疫情相关的各种指导原则,但部分审评标准仍有待调整优化。例如,在疫苗开发上,入组病人要求从未接种过疫苗的受试者,这在实操中实现较为困难;新冠药物主要临床终点的选择和替代终点的选择也值得讨论。
新冠口服药III期临床国家药监局审批标准,目前依旧是以症状改善为“临床终点”,尤其是“降低重/危重患者的死亡率”,而当病毒毒株发生变化,奥密克戎的感染人群大多是无症状感染者和轻症,重症和住院人数占比极少时,中国的临床试验进行极为艰难。如何在新冠治疗药物的评审上找到一种“降低病毒载量”和“减轻症状”之间的平衡,根据最新毒株奥密克戎的特点,进行药审思路的“与时俱进”,或许是下一步中国新冠口服药诞生的关键。
他希望,我国的mRNA疫苗、吸入型疫苗能早日安全、有效的研制成功,能够形成群体免疫,科技抗疫,早日放开国门。线上听众著名病毒学专家黄琦博士与亚盛医药创始人兼CEO杨大俊博士加入讨论。黄琦博士早在当年观合去武汉抗疫时,从美国给寄来了大量短缺的防护用品和实验设备。而亚盛医药尽管专注于肿瘤药,但对于细胞因子风暴与免疫细胞间之间联系非常感兴趣。
两位专家指出,我国P3实验室资源需进一步放开和统筹,国家科技研发资金更多向组织执行力强的企业端倾斜,实现学术科研机构、监管机构、医疗机构、企业临床研究全国一盘棋,是提升我国新冠药物研发效率的有效手段。而中小生物医药企业也要有与病毒共存的长久眼光,积极参与新药研发。
最后,大会主席、南方医科大学南方医院肝病中心主任候金林教授发表总结提出:这次几位专家演讲的内容非常精彩,为后续继续开展新冠临床研究提供了大量实战经验。他也再次呼吁希望能尽快让老年人和具有基础疾病的患者更多接种加强针疫苗,形成群体免疫,有序放开。此外,他也非常赞同国家要将更多政策给予广大药物研发科技工作者,全国统筹组织临床试验。

侯金林教授
他欣喜的看到,不少有责任感的企业,如君实生物、恒瑞医药、歌礼药业、齐鲁制药以及疫苗企业等已经快速加入进来,虽然国外已经有口服药,但价格昂贵,他衷心希望中国的企业能研制出自己的新药,能早日遏制住疫情。
(特别感谢徐颐女士和现场专家的斧正和帮助)

 产业资讯
产业资讯
 医药投资部落
医药投资部落  2025-05-02
2025-05-02
 4
4

 产业资讯
产业资讯
 赛柏蓝
赛柏蓝  2025-05-02
2025-05-02
 5
5

 产业资讯
产业资讯
 瞪羚社
瞪羚社  2025-05-01
2025-05-01
 89
89