 产业资讯
产业资讯
 研发客
研发客  2022-06-02
2022-06-02
 2689
2689
• 根据研发客的统计,自2013年底以来,CDE共发布了12项与儿童用药相关的指导原则。《药品管理法实施条例》修订草案征求意见稿里也特别提及儿童药。
• 优化审评审批的程序鼓励了儿童用药的研发,并加速了相关产品的上市。今年以来,儿童用药领域也是频频有新产品上市。
相对冷门的儿童用药,政策对其的关注度正在提升。上个月国家药监局发布的《药品管理法实施条例修订草案(征求意见稿)》特别谈及了儿童用药,包括鼓励申请人在提交药品上市许可申请时提交研发计划,对于符合条件的儿童药品种给予最长不超过12个月的市场独占期等内容。
事实上,儿童用药近年来得到了政府各部门的重视,并出台了一系列政策与规章鼓励儿童用药的研发以及适用于儿童的新剂型的上市。在此前的4月,国家药监局药品审评中心(CDE)发布了《已上市药品说明书增补儿童用药信息工作程序》及《药审中心关于已上市药品说明书增补儿童用药信息的工作流程》(下文分别简称为《工作程序》和《工作流程》)两个工作程序的征求意见稿。
3月21日,CDE公开了当月初开展的“儿童用药相关指导原则宣讲会”课件,用于业界学习和交流。
在更早的2021年儿童节,CDE已正式在其官网上开通了“儿童用药专栏”,将儿童用药相关的政策法规和培训资料等集中公开,进一步提高了各界对儿童用药的关注和重视。
规范药品说明书儿童用药信息
根据新发布的《工作程序》和《工作流程》起草说明,这两份文件旨在解决我国儿科临床普遍存在的说明书儿童用药信息增补或修订滞后的问题,规范修订说明书增补儿童用药信息的申请处理流程。
文件指出,此项儿童用药信息增补或修订仅限于国家儿科专业协会或国家儿童医学中心提出的申请,与通常的企业自行提出的说明书修订无重叠,不冲突。正式发布后的修订建议公告将成为药品企业递交儿童用药信息补充申请时的修订依据。
其工作程序包括以下几个步骤:
国家儿科专业协会或国家儿童医学中心提出已上市药品信息的申请。
↓
CDE负责对申请进行审核,组织召开专家咨询会议对品种名单进行遴选,审议说明书修订内容,对外共示征求意见,报国家药监局。
↓
国家局审查后以公告形式发布。
《工作流程》明确称品种遴选范围将基于ICH E11(R1),并同时满足以下四个条件:
1. 活性成分制剂已在境内上市(包括进口原研药和满足一致性评价标准的仿制药),已批准用于我国成人和/或部分儿童患者,安全性和有效性明确。2. 活性成分制剂在ICH主要成员国家已获批儿童适应症,具有较充分的研究证据,且说明书中国儿童用法用量明确。3. 活性成分制剂已被我国儿童用药相关指南等推荐用于儿童或已被用于我国儿童患者,且满足用药信息、数据等要求。4. 剂型和规格适用于我国儿童患者。
工作流程还说明了药品企业通过补充申请方式递交修改说明书申请,增补儿童用药信息的处理。
进口原研企业可以直接递交补充申请,而仿制药企业则需要在递交申请前,确保药品已经通过一致性评价或明确属于无需开展一致性评价的范围。对于已申报但未通过一致性评价的品种,不建议递交申请。对于目前尚未纳入一致性评价范畴的,且不属于无需开展的,建议先提交沟通交流申请,获得答复后再行申报。
儿童用药已享有优先审评审批
儿童作为一个特殊群体,其用药研究在伦理和技术方面都面临巨大的困难,因此各国在进行临床试验时都避免纳入儿童患者,由此造成儿童药品安全性、有效性信息不全的局面。因此,市场上儿童专用或者有较为详细的儿童用药信息的药品数量较少,儿童使用成人药品的现象较为普遍。但儿童的身体和药物代谢情况与成人存在较大差异,简单按照体重进行剂量等比例换算,使用成人药物治疗极有可能诱发药物不良事件。
2014年5月,六部委联合印发了《关于保障儿童用药的若干意见》,这是近十几年来我国关于解决儿童用药问题的第一个综合性指导文件。
此前的2013年2月,国家药监局发布《关于深化药品审评审批改革进一步鼓励创新的意见》,鼓励生产企业积极研发仿制药的儿童专用规格和剂型。明确对儿童专用规格和剂型的申请,立题依据充分且具有临床试验数据支持的注册申请,给予加快审评。
2016年1月,CDE组织专家对申请优先审评程序的儿童用药注册申请进行了审核论证,发布《关于临床急需儿童用药申请优先审评审批品种评定基本原则及首批优先审评品种的公告》,首次公布了对临床急需儿童专用药品的优先审评审批品种评定的基本原则,对于未能满足临床需求的儿童用药注册申请,予以优先审评。
与此同时,CDE公布了第一批优先审评审批的儿童用药品种目录,包括氯法拉滨原料与注射液、枸橼酸咖啡因注射液、盐酸普萘洛尔口服溶液、儿童用法罗培南钠干糖浆等5个药品注册申请。
2016年7月,药品审评中心公示第二批优先审评的儿童用药,包括托珠单抗注射液、甘精胰岛素注射液2个品种。各种鼓励儿童用品研发的政策有了实质性的进展。
根据研发客的统计,自2013年底以来,CDE共发布了12项与儿童用药相关的指导原则(见下表)。
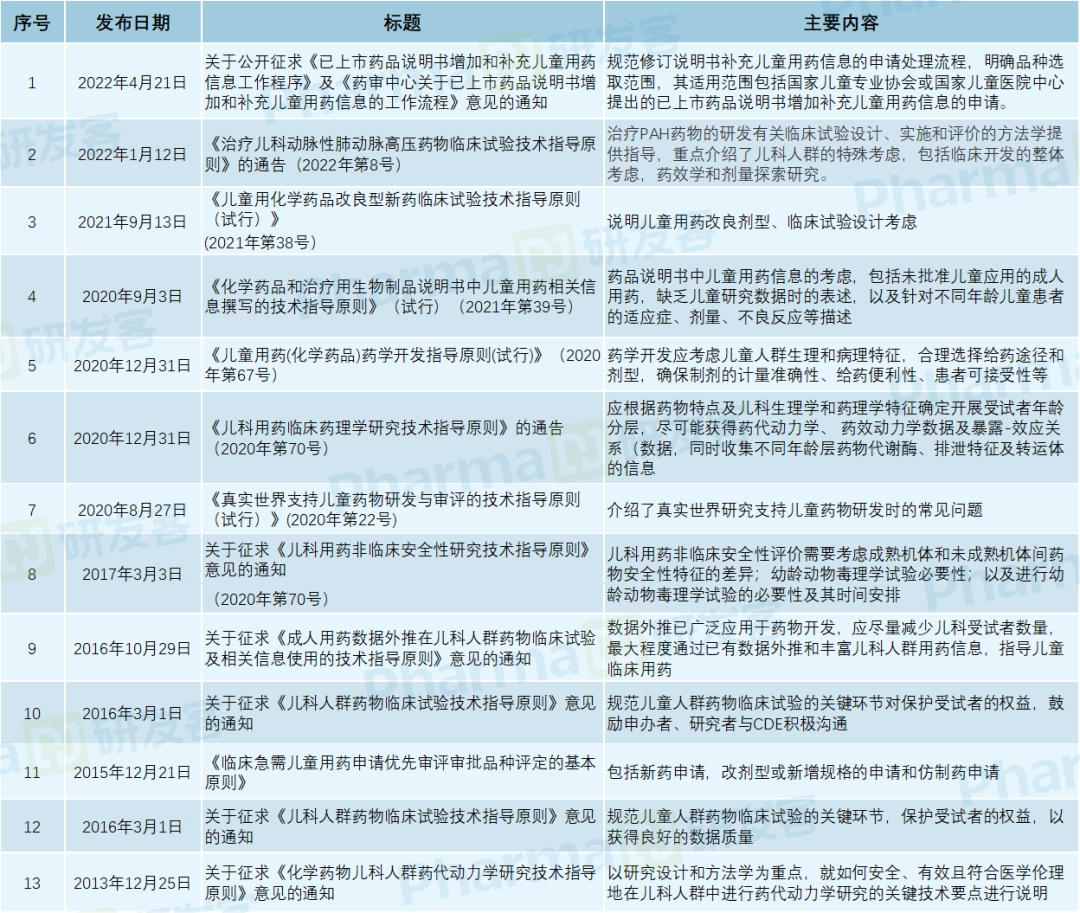
儿童用药上市正在加速
根据研发客的统计,从2016年至2021年底,已有150多个儿童用药被纳入优先审评,近70款成功通过优先审批上市(见下表)。
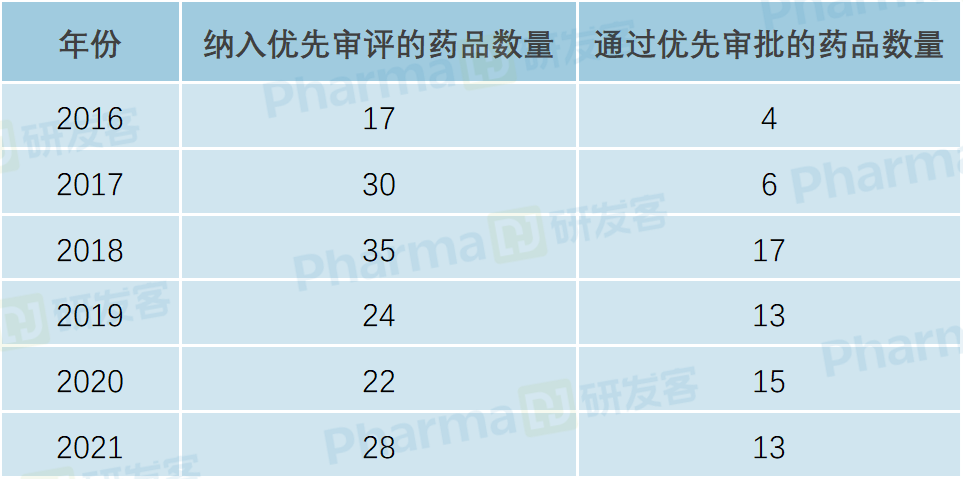
优化审评审批的程序鼓励了儿童用药的研发,并加速了相关产品的上市。国家局公布的数据显示,2020年,批准儿童用药26个,同比增长36.8%,其中国产药品17个,增幅达到46.2%。2021年,有28个儿童用药获批上市,另有45个儿童药和21个新增儿童适应症正在审评中,其中24个品种已纳入优先审评审批,有8个已上市儿童用药说明书进行了规范化补充。
今年以来,儿童用药领域也是频频有新产品上市。5月,拜耳的利伐沙班的儿童剂型(干混悬剂)正式获批。3月,李氏大药厂引进的儿童用麻醉产品Zingo(利多卡因粉末无针经皮注射给药系统)也获得了批准。
可以预见,在国家政策的推动下,未来儿童用药将有望成为又一个新药研发的热点,更多适合儿童的新药和新剂型将上市,真正解决儿童患者用药难的问题。

 产业资讯
产业资讯
 医药投资部落
医药投资部落  2025-05-02
2025-05-02
 4
4

 产业资讯
产业资讯
 赛柏蓝
赛柏蓝  2025-05-02
2025-05-02
 4
4

 产业资讯
产业资讯
 瞪羚社
瞪羚社  2025-05-01
2025-05-01
 89
89