 产业资讯
产业资讯
 Insight数据库
Insight数据库  2022-08-17
2022-08-17
 2821
2821
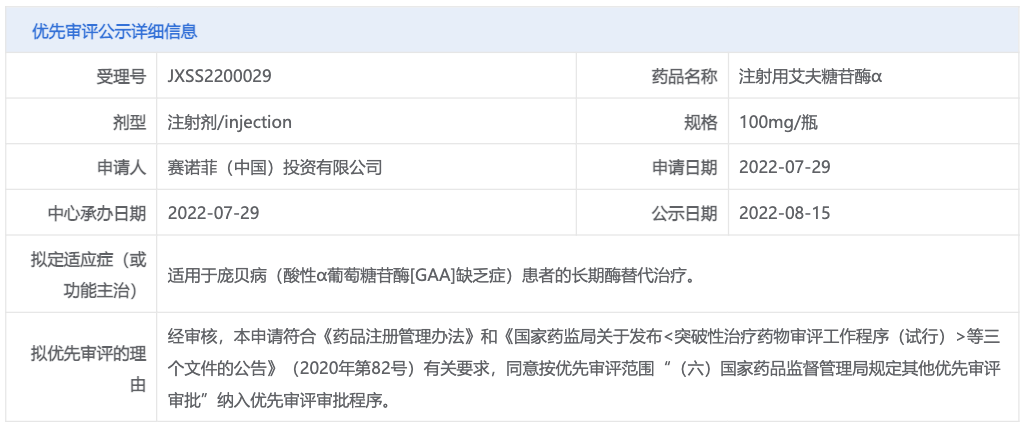
8 月 15 日,CDE 官网显示,拟将赛诺菲注射用艾夫糖苷酶 α 在国内的上市申请纳入优先审评,用于庞贝病(酸性 α 葡萄糖苷酶 [GAA] 缺乏症)患者的长期酶替代治疗(受理号:JXSS2200029)。
来自:CDE 官网
Avalglucosidase alfa:庞贝病第二代酶替代疗法
注射用艾夫糖苷酶 α(Avalglucosidase alfa,商品名:Nexviazyme)是赛诺菲(Sanofi)开发的第二代酶替代疗法,拟用于庞贝病患者。根据发病年龄、受累器官和疾病进展速度,庞贝病分为婴儿型庞贝病(IOPD)和晚发型庞贝病(LOPD)。
据 Insight 数据库显示,Avalglucosidase alfa 已于 2021 年 6 月获 FDA 批准上市,用于治疗 1 岁及以上的晚发性庞贝病患者;今年 6 月,Avalglucosidase alfa 获欧盟委员会批准,用于长期治疗庞贝病,包括 LOPD 或 IOPD 。
此前,针对 LOPD 患者,赛诺菲曾披露一项头对头 III 期 COMET 研究数据。COMET 是一项随机、多中心、双盲研究(登记号:NCT02782741),旨在对比在首次接受治疗的晚发型庞贝病(LOPD)患者中每两周静脉输注一次(20 mg/kg) Avalglucosidase alfa 或阿糖苷酶α(Alglucosidase alfa) 的有效性和安全性。
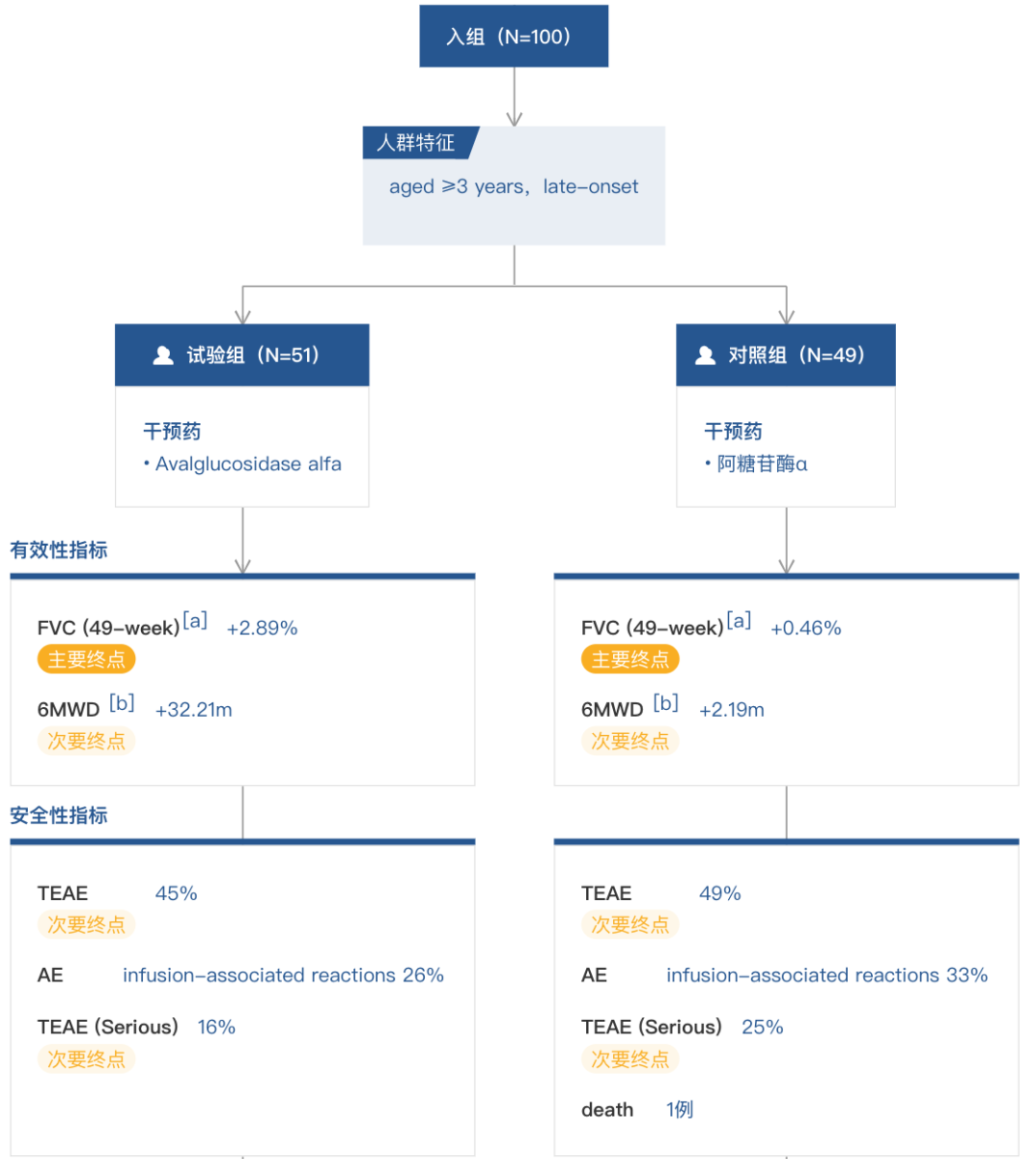
结果显示,治疗近一年(49 周)期间,接受 Avalglucosidase alfa 治疗的患者,其关键表现(呼吸障碍和活动能力下降)显示出临床意义的改善,且疗效非劣效于阿糖苷酶 α,研究达到主要终点:
治疗第 49 周,Avalglucosidase alfa 组患者预测的用力肺活量(FVC)百分比与基线检查时相比提高了 2.9 分(SE = 0.9)、与阿糖苷酶 α 组相比有 2.4 分的更大改善,达到了非劣效性标准(p = 0.0074;95%CI: -0.13,4.99)。
该试验的一个关键次要终点通过 6 分钟步行试验(6 MWT)测定功能耐力,在治疗第 49 周, Avalglucosidase alfa 组患者与基线检查时相比步行距离增加了 32.21 米(SE = 9.9)、与 Alglucosidase alfa 组相比多走了 30 米(95%CI: 1.33,58.69)。根据研究方案的分层结构,没有对所有次要终点进行正式的统计学检验。
COMET 临床试验结果总览图

来自:Insight 数据库网页版
此外,另一项 mini-COMET 研究则评估了 Avalglucosidase alfa 治疗 IOPD 患者的安全性和探索性疗效(登记号:NCT03019406)。
该研究入组的患者曾接受过阿糖苷酶α 治疗,但未能充分缓解。在试验中,患者被随机分配接受 2 种剂量(20 mg 或 40 mg/kg 体重) Avalglucosidase alfa 治疗,或接受其目前稳定剂量的阿糖苷酶 α。
结果显示,接受 6 个月治疗后,2 种剂量 Avalglucosidase alfa 耐受性良好,无严重副作用。此外,Avalglucosidase alfa 组患者也有较低或稳定水平的疾病生物标志物肌酸激酶和葡萄糖四糖。
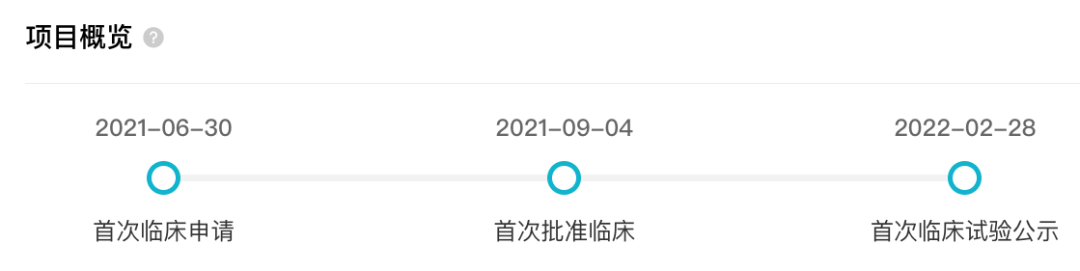
在国内,Avalglucosidase alfa 于 2021 年 9 月首次获批临床,今年 2 月首次公示临床试验,7 月申报上市,并于今日拟纳入优先审评。
avalglucosidase alfa 国内开发关键节点
来自:Insight 数据库网页版(http://db.dxy.cn/v5/home/)
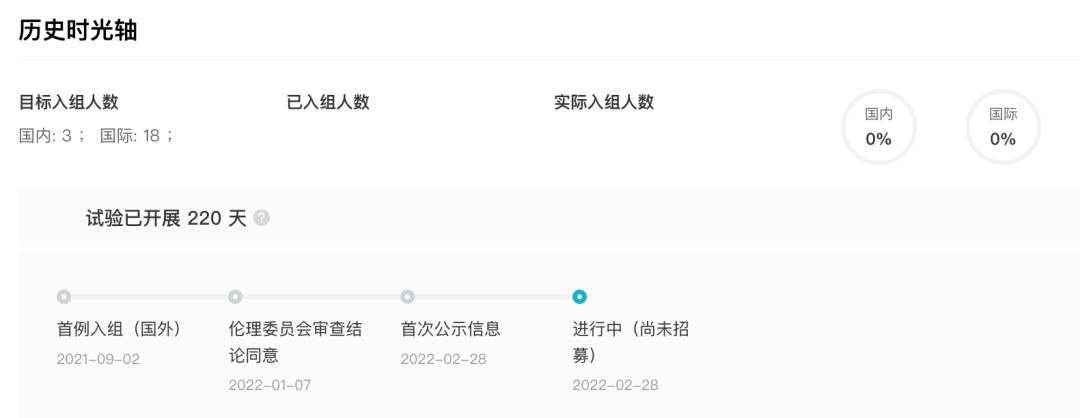
目前,据 Insight 数据库显示,赛诺菲正在国内开展一项未经治疗的婴儿型庞贝病(IOPD)儿童受试者中评价 Avalglucosidase alfa 的疗效、安全性、药代动力学和药效学的开放标签、多中心静脉输注 III 期临床研究(登记号:CTR20220417),该研究于今年 2 月首次公示临床试验,当前正在进行中。
CTR20220417 临床试验

来自:Insight 数据库网页版
阿糖苷酶 α:第一代酶替代疗法
庞贝病(糖原累积病 Ⅱ 型)是一种罕见的、致命的常染色体隐性遗传病,由于遗传缺陷或溶酶体酶酸性α-葡萄糖苷酶(GAA)功能紊乱,导致肌肉(包括近端肌肉和膈肌)糖原积聚,最终导致进行性和不可逆的肌肉损伤。
当前,针对庞贝病的有效治疗方法是酶替代治疗(ERT),其可将防止肌肉中糖原积聚所必需的酶 GAA 导入肌肉细胞内的溶酶体,以取代缺失或缺乏的 GAA。
在 Avaloglucosidase alfa 之前,阿糖苷酶 α 是唯一被批准治疗庞贝病的酶替代疗法(ERT)。阿糖苷酶 α 也是由赛诺菲研发,早于 2006 年 4 月获 FDA 批准上市。
阿糖苷酶 α 全球开发进度关键节点

来自:Insight 数据库网页版
在国内,阿糖苷酶 α 于 2015 年首次批准临床,同年 6 月申报上市,约 4 个月后即获批上市。目前庞贝病已被纳入中国第一批罕见病目录,阿糖苷酶 α 是目前国内唯一获批上市治疗庞贝病的特效药物。
据 Insight 数据库显示,针对 IOPD 和 LOPD 患者,当前阿糖苷酶 α 正在国内开展两项 IV 期临床研究(登记号:CTR20200942、CTR20201882)。
CTR20200942、CTR20201882 临床试验

来自:Insight 数据库网页版
而针对 IOPD,近期赛诺菲刚披露了一项注射用阿糖苷酶 α 治疗中国 IOPD 患儿的临床试验数据,这是首个在中国大陆进行的针对 IOPD 患儿 ERT 治疗临床研究,填补了该领域本土研究的空白。
这是一项前瞻性、多中心 APOLLO-IOPD 研究,旨在评估中国 IOPD 患儿 ERT 治疗的有效性及安全性(登记号:NCT03687333)。主要研究终点为治疗 52 周时生存率和左心室质量指数(LVMI)较基线变化。
研究对象为10 例确诊的 IOPD 患儿,患儿每 2周 接受一次剂量为 20 mg/kg 的注射用阿糖苷酶α ,持续 52 周。研究结果显示,中国 IOPD 患儿接受 ERT 治疗后,生存率提高、心肌肥厚改善、生长发育促进、运动能力发展,疾病进展得到延缓。同时,患儿耐受可,安全性良好。
NCT03687333 临床试验结果

来自:Insight 数据库网页版
与阿糖苷酶 α 相比,Avaloglucosidase alfa 经过专门设计,通过对肌肉细胞上 M6P 受体更大的亲和力,增强受体靶向性和酶吸收,以增强糖原清除并提高阿糖苷酶 α 的临床疗效。临床前研究显示,Avaloglucosidase alfa 在降低组织糖原方面表现出约阿糖苷酶 α 5 倍的功效。在庞贝氏症小鼠模型中,Avaloglucosidase alfa 在五分之一剂量阿糖苷酶 α 时,即表现出相似的底物降低水平。
深耕罕见病领域:赛诺菲在研 67 款新药
赛诺菲作为罕见病治疗领域的领先者之一,据 Insight 数据库显示,目前在罕见病领域赛诺菲共有 67 款新药(含改良新)在研。其中,化药 28 款,占比 41.79%,此外,还涉及 单抗、双抗、多肽、抗体类融合蛋白等。
赛诺菲罕见病新药成分类别分布
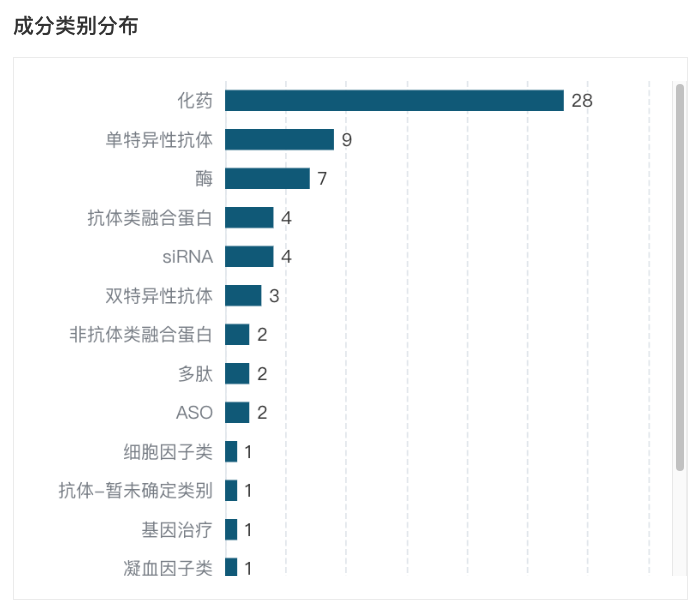
来自:Insight 数据库网页版
从疾病领域来看,赛诺菲在针对溶酶体贮积症(LSDS)治疗方面有着广泛布局,除庞贝病外,赛诺菲还在研发针对法布里病、戈谢病等罕见病新药。此外,赛诺菲同时也在大力推进用于治疗 GM2 神经节苷脂沉积症(包括 Tay-Sachs 病、AB 变异型和 Sandhoff 病)及酸性鞘磷脂酶缺乏症的新药研发。
在国内,赛诺菲罕见病新药已获批上市 9 款。于 2018 年 7 月,特立氟胺在国内获批上市,适用于复发型多发性硬化患者治疗,成为国内获批治疗多发性硬化的首款口服型疾病修正治疗药物。2019 年 12 月,赛诺菲研发的阿加糖酶 β 在国内获批上市,用于治疗法布里病;该药是国内获批的首个用于治疗法布里病的药物,适用于 8 岁以上的儿童和青少年及成人。此外,还涉及戈谢病、ALS、庞贝病等疾病。

 产业资讯
产业资讯
 医药投资部落
医药投资部落  2025-05-02
2025-05-02
 4
4

 产业资讯
产业资讯
 赛柏蓝
赛柏蓝  2025-05-02
2025-05-02
 3
3

 产业资讯
产业资讯
 瞪羚社
瞪羚社  2025-05-01
2025-05-01
 88
88