 会员动态
会员动态
 医药观澜
医药观澜  2022-12-28
2022-12-28
 2792
2792
今日(12月27日),中国国家药品监督管理局药品审评中心(CDE)官网最新公示,信达生物申请的1类新药GFH925片拟纳入突破性治疗品种,拟用于至少接受过一种系统性治疗的KRAS G12C突变型的晚期非小细胞肺癌(NSCLC)患者。公开资料显示,GFH925是劲方医药研发的一款KRAS G12C抑制剂,信达生物通过合作获得了它在大中华区的开发和商业化权利。
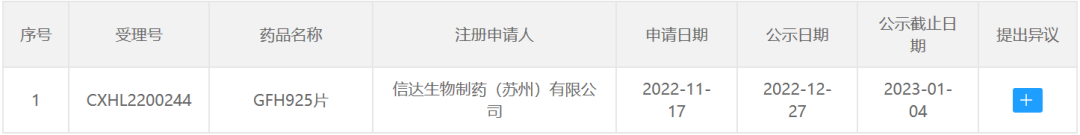
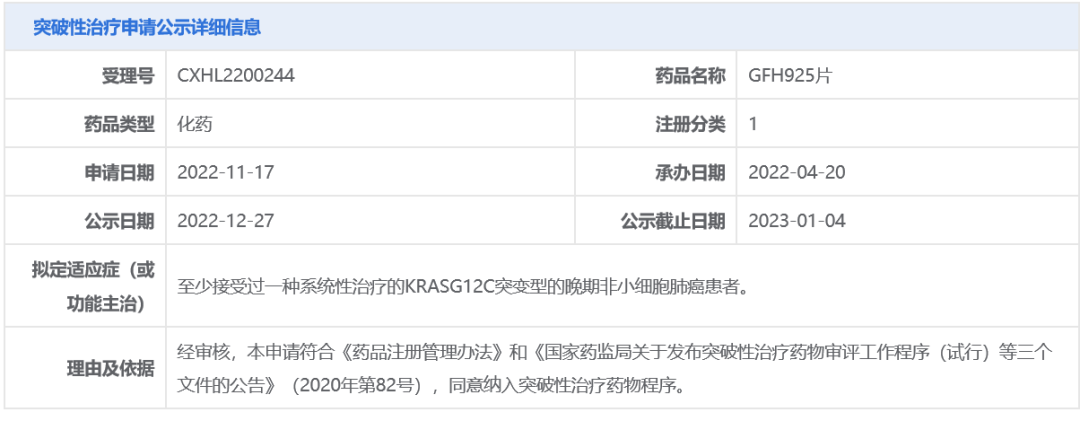
截图来源:CDE官网
GFH925(IBI351)是一款高效口服新分子实体化合物,通过共价不可逆修饰KRAS G12C蛋白突变体半胱氨酸残基,有效抑制该蛋白介导的GTP/GDP交换从而下调KRAS蛋白活化水平;临床前半胱氨酸选择性测试也显示,GFH925对于该突变位点的高选择性抑制效力。此外,GFH925抑制KRAS蛋白后可进而抑制下游信号传导通路,有效诱导肿瘤细胞凋亡及细胞周期阻滞,达到抗肿瘤效果。
2021年9月,信达生物与劲方医药宣布达成全球独家授权协议,信达生物将作为独家合作伙伴获得GFH925在中国(包括中国大陆、香港、澳门及台湾地区)的开发和商业化权利,并拥有全球开发和商业化权益的选择权。劲方医药负责该药物在临床研究阶段和商业化阶段的药物生产供应。
根据CDE公示,此次GFH925片拟纳入突破性治疗品种,拟用于KRAS G12C突变型晚期非小细胞肺癌患者。肺癌是最常见的癌症类型,其中NSCLC约占肺癌病例的80%~85%。多数NSCLC患者携带不同的基因突变,KRAS G12C突变是其中常见突变形式(约13%),带有这种突变的NSCLC患者通常对其它靶向药物具有耐药性,并且往往预后不佳,因此这类患者迫切需要针对性的靶向治疗。
此前,信达生物已在2022年中国临床肿瘤学会(CSCO)年会上以口头报告形式公布了GFH925单药治疗晚期实体瘤患者的1a期研究的更新结果。截至2022年7月29日,该研究共入组67例既往经过标准治疗失败或不耐受的晚期恶性肿瘤受试者,其中61例非小细胞肺癌。近50%的受试者既往接受过2线及以上治疗,肺癌患者中37.7%基线存在脑转移。
研究结果显示,在55例非小细胞肺癌疗效可评估人群中,客观缓解率(ORR)为50.9%,疾病控制率(DCR)为92.7%;绝大部分缓解患者仍在持续治疗中;低剂量组即显示持续肿瘤缓解,最长治疗持续时间已达8.9个月(450mg一天一次剂量组),且仍在持续治疗中;中位缓解持续时间和中位无进展生存时间均未达到。600mg一天两次剂量组(2期推荐剂量)呈现更优的疗效,在21例可评估受试者中,客观缓解率(ORR)和疾病控制率(DCR)分别为61.9%(13/21)和100%。
安全性方面,截至数据分析日,总体耐受性良好,各剂量组未观察到剂量限制性毒性(DLT)事件,MTD未达到。共有92.5%(62/67)的受试者发生药物相关不良事件(TRAEs),大部分为1-2级,最常见的TRAE为贫血、转氨酶升高、胆红素升高,瘙痒和乏力。19.4%的受试者发生≥3级TRAEs,无导致死亡以及导致治疗终止的TRAEs发生。
目前,GFH925单药针对携带KRAS G12C突变的晚期非小细胞肺癌的单臂注册研究正在进行中。希望信达生物引进的这款KRAS G12C抑制剂在临床研究中取得更多突破,早日为NSCLC患者带来更多治疗选择。
参考资料:
[1]中国国家药监局药品审评中心(CDE)官网. Retrieved Dec 27, 2022, from https://www.cde.org.cn/main/xxgk/listpage/9f9c74c73e0f8f56a8bfbc646055026d
[2]信达生物与劲方医药关于GFH925(KRAS G12C抑制剂)达成全球战略合作. Retrieved Sep 02,2021, from https://mp.weixin.qq.com/s/37P2E2xVCrwOzH486ErZCA
[3]信达生物在2022年中国临床肿瘤学会(CSCO)年会公布KRAS G12C抑制剂IBI351单药治疗实体瘤的临床I期数据.Retrieved Nov 12 , 2022, from https://mp.weixin.qq.com/s/Iz0BTT113Hg1vt1WxPxWYg

 会员动态
会员动态
 医药观澜
医药观澜  2026-01-29
2026-01-29
 202
202

 会员动态
会员动态
 先声药业
先声药业  2026-01-29
2026-01-29
 206
206

 会员动态
会员动态
 药怪站住
药怪站住  2026-01-28
2026-01-28
 214
214