 产业资讯
产业资讯
 注册圈
注册圈  2023-03-10
2023-03-10
 8186
8186
前言
药品技术转移可以定义为“将药品的知识、技术以及相关联的产品和工艺过程,从转出方(如CRO/MAH/CMO等),转移到接收方(如MAH/CMO/CRO等)的过程”。技术转移作为产品生命周期的一部分,可以发生于不同阶段,且可以多次发生,目前技术转移相关指南多侧重于上市申请及商业化阶段,随着国家实施MAH制度、鼓励创新药等政策的不断推进,在产品IND阶段,技术转移也常发生,只是由于对产品和工艺的了解信息有限,IND阶段技术转移更注重真实性、可追溯性,而商业阶段技术转移,监管合规性期望会更高。药品技术转移应该按照项目而不仅是一个过程去管理,其顺利实施,依赖于良好的知识转移、对产品和工艺的理解以及高效项目管理。
药品技术转移,往往以满足阶段性要求为目标,如IND阶段转移,常以生产合格临床样品和稳定性考察(满足临床使用过程中稳定性)为目标,合规性应满足NMPA关于《临床试验用药品附录的公告(2022年第43号)》要求(FDA、欧盟、WHO均发布了IND阶段GMP规范,涉及国外注册时可以参考);而上市注册和商业化阶段转移,常以完成工艺验证、稳定性考察、递交注册申报为目标,合规性应满足现行GMP、注册申报等要求,其中知识管理的重要性,也正逐渐被业界重视。
PDA、ISPE、WHO、中国等均发布了技术转移相关指导规范,相关信息汇总如下表:
表-1主要药品技术转移指南汇总表
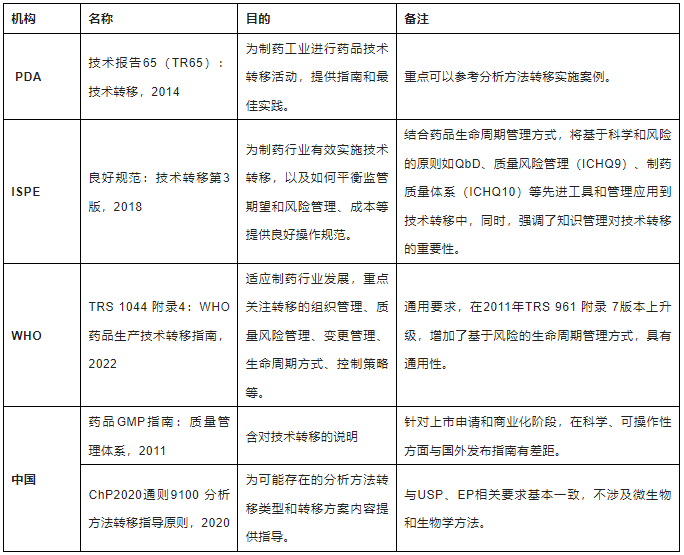
技术转移一般通过变更管理程序,正式进入到接收方内部管理体系。药品技术转移主要指药学CMC转移,主要涉及产品、工艺以及分析方法转移,三者相互关联。笔者重点参考ISPE 和WHO的技术转移指南,结合实际工作经验对技术转移流程、风险评估、转移实施等要点进行阐述,便于为同行实施技术转移提供可操作性建议。
01 技术转移一般流程
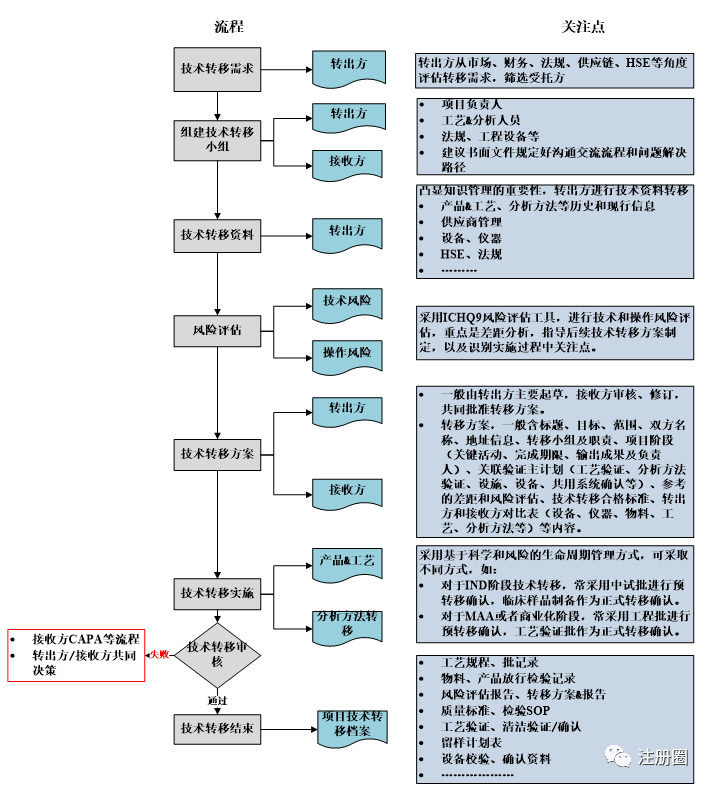
药品技术转移,首先需要确定技术转移需求,然后转出方和接收方共同组建技术转移小组,进行后续的技术资料转移、风险评估、撰写技术转移计划/方案、实施技术转移等工作,技术转移一般流程及关注点见下图1:
图1-药品技术转移一般流程
02 技术转移资料
技术资料的转移本质上就是产品知识的转移,知识管理尤其重要,通常在组建转移小组后,由转出方及时提供给接收方。基于生命周期管理思路,不同阶段,可转移资料存在区别,国内制药企业对药品技术转移管理和实施的重视程度及规范性,较国外仍存在差距,尤其涉及重大项目或者国内外转移时,建议可参考ISPE指南列举的资料清单(针对商业化阶段,见下表2),提供相关等同性资料,资料提供的越全面,越利于技术转移实施。
表2-技术资料清单
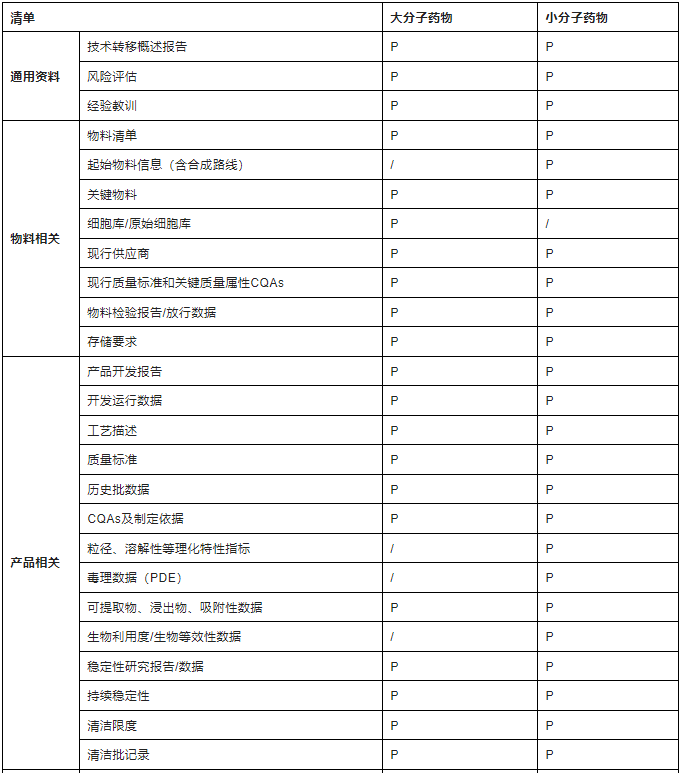
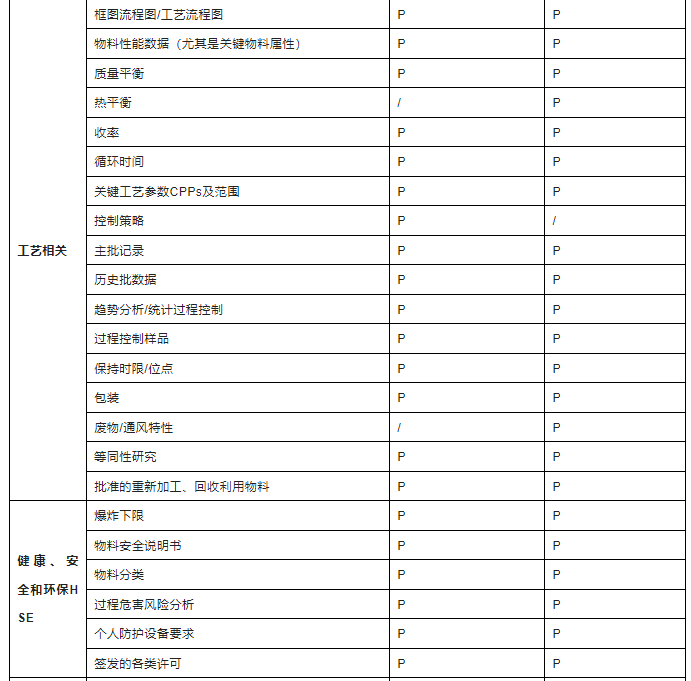
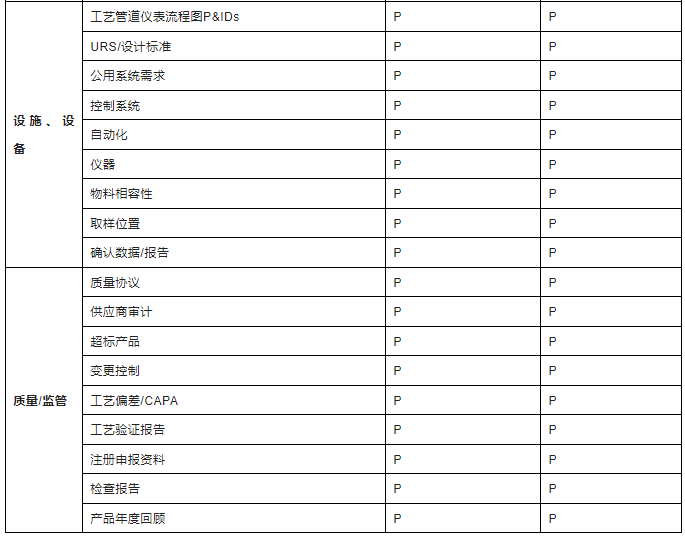
注:考虑到保密性和信息有限性,对于IND阶段,技术转移资料可以根据实际情况,评估提供,以满足临床样品制备和检验需求为最低要求。
03 风险评估
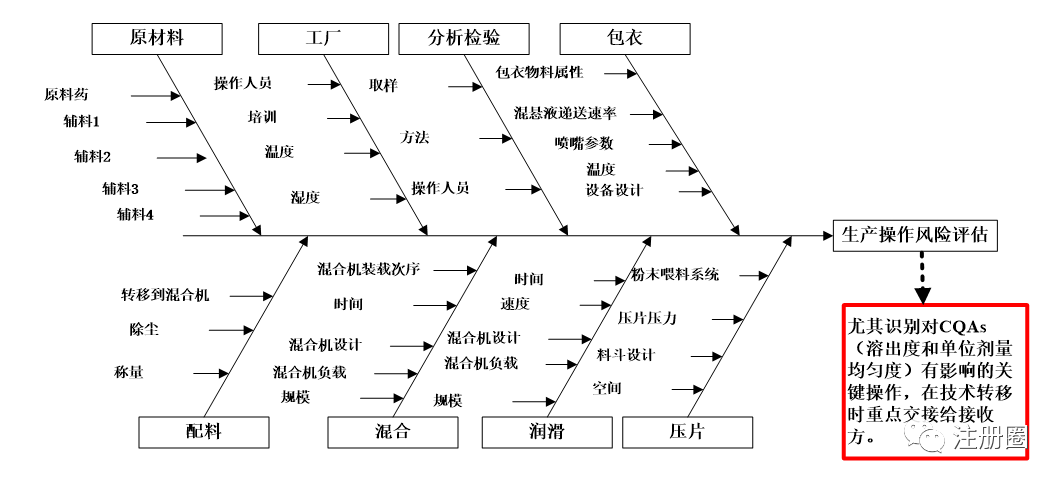
风险评估十分重要,有利于识别转出方和接收方在设施设备、工艺、检验仪器、对产品理解等方面存在的差距,为后续转移方案及控制策略制定提供依据。建议条件允许时采用面对面的交流评估方式,降低转移双方信息差,便于接收方更深入地理解产品和工艺性能,推荐采用鱼骨图,从物料、仪器设备、方法、人员、测量、环境等方面进行转移评估,尤其需要识别出对CQAs有影响的CPPs,和接收方重点阐述说明,以某固体制剂项目转移为例,其操作风险评估鱼骨图可采用下图2方式呈现:
图2-某固体制剂技术转移操作风险评估鱼骨图
04 技术转移实施
4.1 分析方法转移
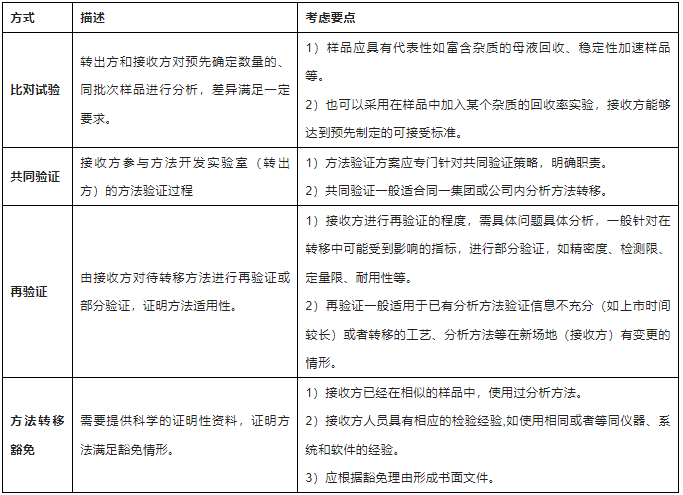
定性分析方法如外观、IR鉴别等一般无需进行方法转移,通过培训即可,定量方法如含量、有关物质、溶出度等,一般需要进行方法转移,方法转移类型主要有比对试验、共同验证、再验证、转移豁免等四类,其中比对试验是最常用的方式,分析方法转移常见类型及考虑要点见下表3:
表3-分析方法转移实施类型
4.2 产品/工艺转移
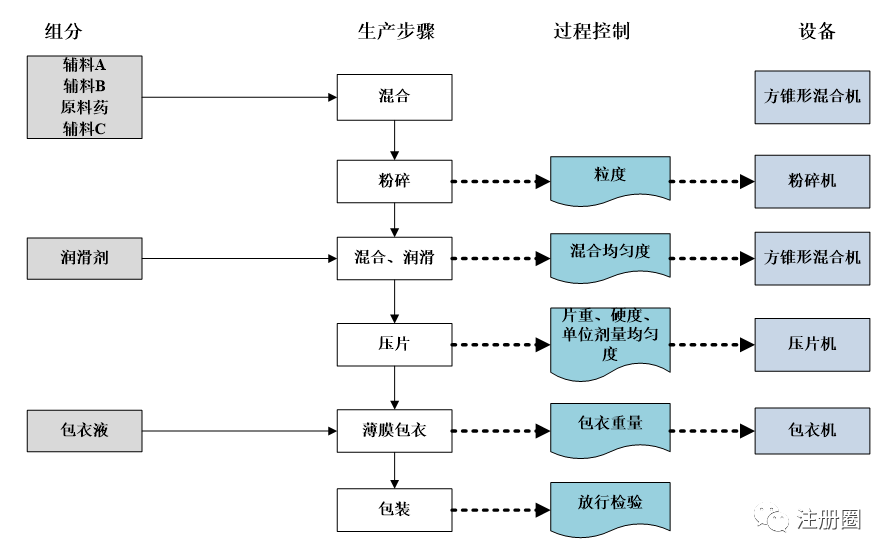
产品/工艺技术转移通常围绕,如何回答以下3个问题进行:1)当前的工艺/产品是什么?2)基于任何与新场地相关的限制因素/标准,期望的最终产品/工艺是什么? 3)为了证明产品准确、工艺稳健,需要进行什么样的支撑性工作?推荐采用框图流程图(含组分、生产步骤、过程控制、设备等),对待转移产品及工艺进行可视化呈现,便于接收方增强理解,如某片剂产品/工艺转移的框图流程图示例如下:
图3-某片剂框图流程图示例
进行产品/工艺转移,通常都涉及分析方法转移,常需要更广泛的取样计划,收集接收方初始转移实施信息,跟踪关键指标检验。IND阶段技术转移,通常以生产合格临床样品为目标,技术转移通常会首先进行试生产(中试批)或者空白模拟,考察工艺参数和设备可行性,然后进行正式临床样品制备。而上市注册/商业阶段技术转移,常以完成工艺验证为目标,工艺验证实施前,通常可采用工程批对工艺性能、产品质量符合性进行预先确认,当结果显示性能和质量均接近边缘指标时,提示需要进行工艺优化;若各指标均能很好满足预设指标,则可以进行工艺验证。
05 技术转移结束
技术转移实施过程中和完成后,均应该对开展情况进行审核,确保后续的稳定性研究、监管承诺、质量管理系统等工作有序开展,理想的技术转移实施,工艺、产品及稳定性趋势等应符合预期目标,且涉及的偏差和变更等均已记录和调查,一般会输出技术转移报告,相应的转移档案资料需要一并收集,及时反馈给转出方。
当过程和结果显示转移不成功时,需要通过接收方的CAPA程序进行全面调查,反馈转出方,转出方和接收方共同决策。

 产业资讯
产业资讯
 17Talk易企说
17Talk易企说  2025-06-27
2025-06-27
 40
40

 产业资讯
产业资讯
 医药笔记
医药笔记  2025-06-27
2025-06-27
 41
41

 产业资讯
产业资讯
 医药魔方Invest
医药魔方Invest  2025-06-27
2025-06-27
 46
46