 产业资讯
产业资讯
 凯莱英药闻
凯莱英药闻  2023-06-30
2023-06-30
 2208
2208
近日,有关两条礼来的收购消息被批露;首先是礼来和 Sigilon Therapeutics(简称“Sigilon”)达成一项最终协议。根据协议条款,礼来将启动要约收购,以每股 14.92 美元的现金(总计约 3460 万美元)收购 Sigilon 的所有已发行股票;此外,持有人将有权额外获得每股最多111.64 美元的现金,收购总价最高约 3.096 亿美元。该交易预计将于2023年第三季度完成。其次,Herdelberg Pharma宣布出售Emergence Therapeutics(简称“Emergence”)的少数股份;同时透露,礼来将收购Energence。
一 关于Sigilon以及糖尿病细胞疗法
Sigilon是一家临床阶段的生物制药公司,通过为患者提供稳定和持久水平的治疗分子,正在为慢性病患者开发一类新型疗法和功能性疗法。
(一)公司平台简介
自 2018 年以来,礼来和Sigilon 共同开发封装细胞疗法,包括用于治疗 1 型糖尿病的SIG-002。
糖尿病患者通过注射胰岛素对病情进行控制的方式,其实是通过移植制造胰岛素的胰脏细胞使病情得到改善。但细胞植入有一个主要缺点,那就是会引起免疫反应。
虽然,科学家们发明了一种用半透性的保护膜包裹细胞来避免受到免疫系统的攻击,但如果免疫系统识别出该保护性物质是外来者,就会导致疤痕组织的生长,即通过纤维化的方式来阻止营养物质进入细胞,从而导致细胞死亡。
然而,Sigilon的Shielded Living Therapeutics™(SLTx)平台上的封装细胞疗法,可以克服上述免疫反应和纤维化的局限。
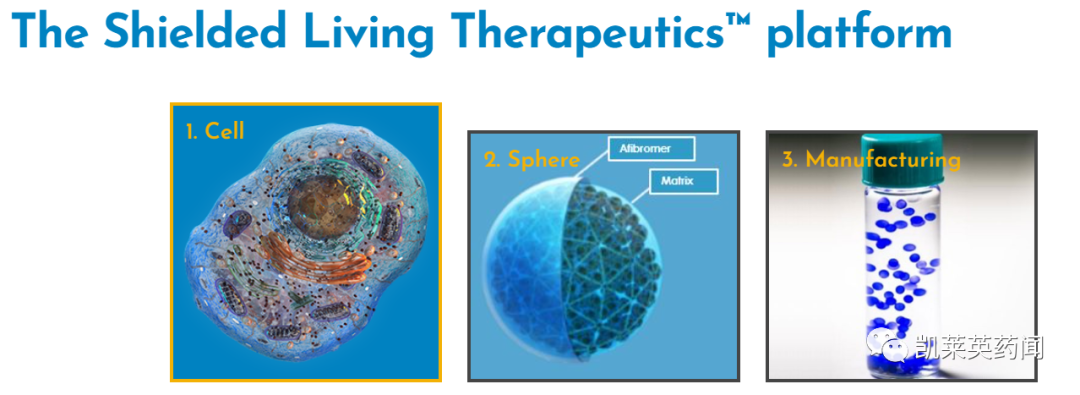
该平台主要包括以下三个主要部分:
1、特定的工程细胞开发。这些细胞可以以恒定的速度释放和传递人体所需的物质,并能感知和响应变化的环境。它们不仅可以进行大规模的生产,还能够在封装的环境中生存良好。
2、保护工程细胞的球体制造。这种球体是建立在麻省理工学院的基础性发现上,是一种可容纳数千个治疗细胞的双层球体。
外层是通过Afibromer™封装平台开发出的生物相容性材料,可以防止免疫反应和降低纤维化程度,并且满足营养物质的流入和蛋白质的流出;
内部隔层可以优化细胞的生存能力和生产力。
3、产品制造。SLTx平台是一个模块化的平台,这些模块在所有的药物开发项目中都是共享的,这使Sigilon开发效率和成本效益得到了提升。
被植入的球体和其中的细胞,像一个活体药物工厂,可以持续发挥效用;且这是一种不需要根据病人的情况进行逐个设计和定制,可以用于不同病人的方法。即大大降低了药物制造的成本,也改善了病人接受治疗的速度和便利性。
(二)公司管线
Sigilon的产品线涵盖一系列内分泌和溶酶体疾病,目前专注于糖尿病;产品设计为现成的、耐用的、可控的和可重复的,不需要修改患者的基因即可长期抑制患者的免疫系统。
其中,SIG-002预计将于2023年下半年提交IND申请,并预计将在2024年进行潜在的临床试验。此前,公司SIG-001、SIG-005和SIG-007曾分别获FDA的孤儿药认定,用于A型血友病(HA)、I型粘多糖病(MPS-1),以及法布雷病。
此前,SIG-001 的I/II期试验于2021年被搁置,当时该公司宣布从第三名接受SIG-001治疗的患者身上回收了纤维化球体,并且这些球体是通过其SLTx平台创建的,这一纤维化问题也导致该项封装细胞疗法失败,但具体原因不明。

(三)糖尿病细胞疗法
全世界有4.63亿成年人 (每11人中就有1人) 患有糖尿病,预计到2045年,这一数字将达到7亿。每年有420万人死于糖尿病,我国有近1.3亿糖尿病患者。1型糖尿病占全球糖尿病病例的大约10%, 2型糖尿病占90%左右。
目前,胰岛移植虽可以改善患者的胰岛素不足问题,但是供源不足,且需要长期服用免疫抑制剂,临床上无法大规模开展。细胞技术的飞速发展,生物材料科学的进步,使再生医学离临床转化越来越近,有望成为最有潜力的糖尿病替代治疗策略。
6月28日,FDA宣布批准CellTrans公司的同种异体胰岛细胞疗法Lantidra上市,用于治疗1型糖尿病成人患者。Lantidra是有史以来第一个获批用于治疗1型糖尿病的细胞疗法,可为1型糖尿病和复发性严重低血糖患者提供了一种额外的治疗选择,具有里程碑的意义。
除礼来外,其它专注于糖尿病药物开发的企业也纷纷加码细胞疗法,其中:
2023年4月,诺和诺德与加拿大生物技术公司 Aspect Biosystems达成合作,以 7500 万美元初始付款引进 4 款用于治疗糖尿病和肥胖症的生物打印组织疗法,利用Aspect的专有生物打印技术,以及诺和诺德在干细胞分化、细胞治疗开发和制造方面的专业知识和技术,共同开发可植入的同种异体的生物打印组织,以替代、修复或补充体内的生物功能。根据协议条款,每款药物都有 6.5 亿美元潜在里程碑付款和分层特许权使用费,交易总价值高达 26 亿美元。
2023年3月,Vertex Pharmaceuticals和CRISPR Therapeutics就使用CRISPR的基因编辑技术CRISPR/Cas9达成一项新的非排他性许可协议,加速Vertex针对1型糖尿病(T1D)的低免疫细胞疗法的开发。根据协议条款,Vertex将预先向CRISPR支付1亿美元,以获得CRISPR技术的非独家权利,用于开发T1D的低免疫基因编辑细胞疗法;CRISPR 将有资格获得高达2.3亿美元的研发里程碑,以及获得该协议产生的任何未来产品的版税。
近日,Vertex在ADA年会上汇报了干细胞疗法VX-880治疗一型糖尿病的1/2期临床最新数据。VX-880 是一种研究中的同种异体干细胞衍生的、完全分化的、产生胰岛素的胰岛细胞疗法,采用专有技术制造;有潜力通过恢复胰岛细胞功能(包括葡萄糖反应性胰岛素的产生)来恢复人体调节葡萄糖水平的能力。最新数据显示,治疗后,所有患者均表现出胰岛素分泌恢复、血糖控制改善、时间范围改善、外源性胰岛素使用减少或消除,并且在第 90 天后的评估期间完全没有严重低血糖事件。
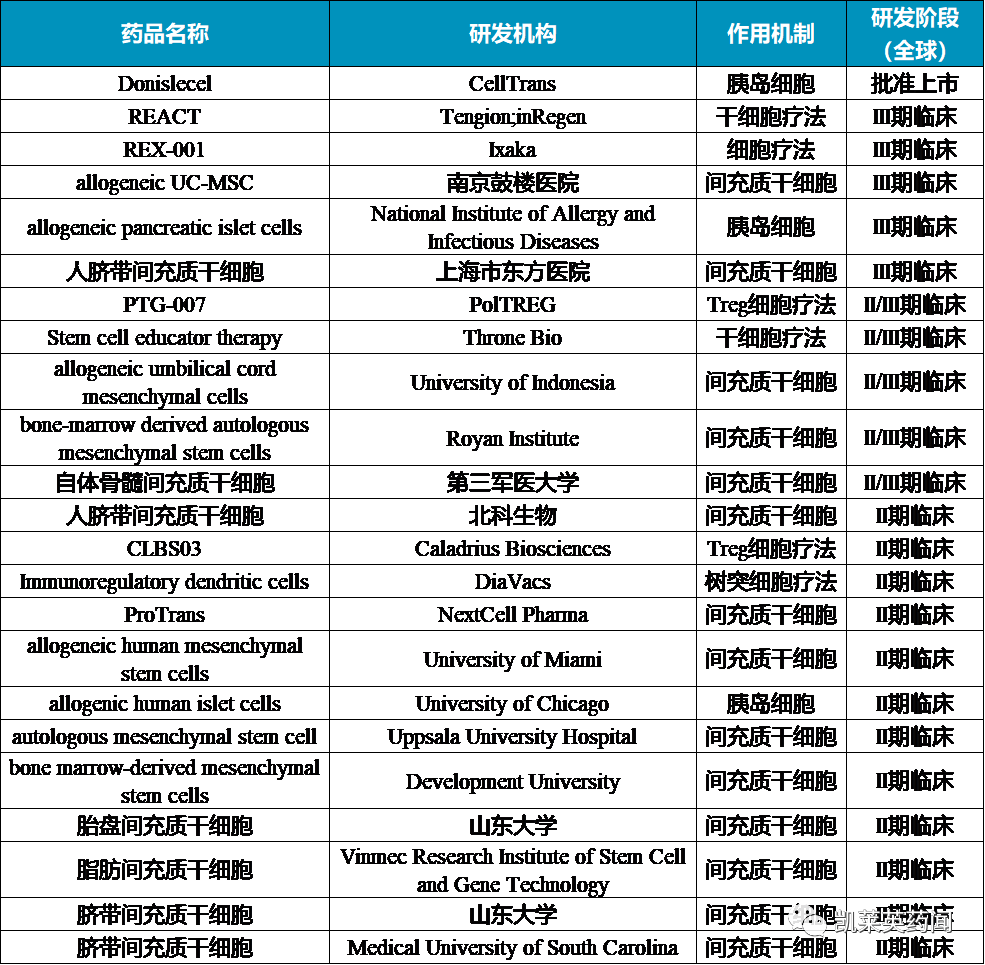
据不完全统计,目前在研的糖尿病细胞疗法约90余种,将II以上临床阶段的药物统计如下:
二 关于Emergence及靶向Nectin-4 ADC
Emergence是一家欧洲生物制药公司,开发新型抗体药物偶联物(ADC)疗法,以治疗高度为满足需求的癌症。公司采用创新的抗体设计以及最先进的接头和有效载荷技术,以靶向Nectin-4。
公司在研药物ETx-22能够与表达Nectin-4的肿瘤细胞选择性、高亲和力地稳定结合;最初将开发用于膀胱癌和三阴性乳腺癌,以及具有Nectin-4表达水平的恶性肿瘤,包括卵巢癌,头颈癌和肺癌。
Nectin的靶点介绍及 ADC研发情况
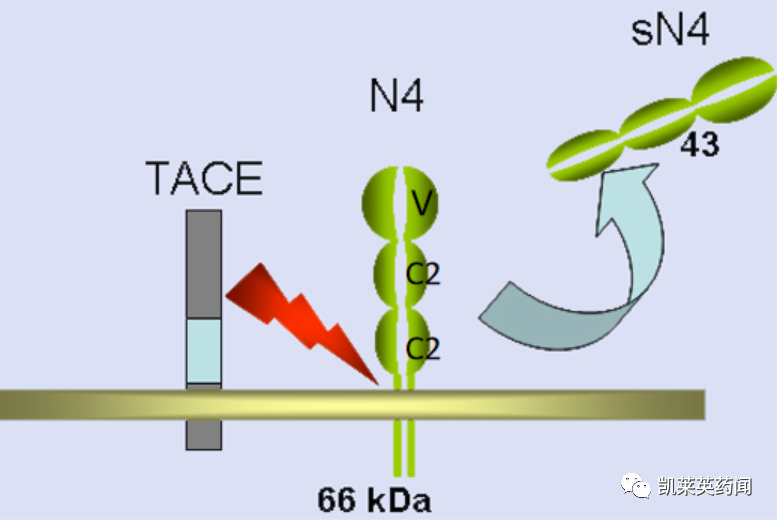
Nectin属于免疫球蛋白超家族的细胞黏附分子。这个蛋白家族共有四个成员:Nectin-1,Nectin-2,Nectin-3,Nectin-4。
Nectin-4在正常的胚胎和胎儿组织中含量高,在成人健康组织中表达量很低,但在多种肿瘤细胞如:在尿路上皮癌、膀胱癌、乳腺癌、卵巢癌、胃癌、肝细胞癌和胰腺癌等组织中,具有特异性的高表达,与肿瘤的发生和转移具有密切的关系。
目前,全球有13款靶向Nectin-4的ADC药物处于研发阶段。
其中在2019年12月,FDA加速批准了Seagen与安斯泰来的抗体药物偶联物——Padcev(enfortumab vedotin),用于治疗局部晚期或转移性尿路上皮癌(UC)患者,成为首个以Nectin-4为靶点的获批ADC药物。
国内企业中,迈威生物的研发阶段最为靠前,百奥泰、恒瑞、启新生物、石药集团的靶向Nectin-4的ADC药物也均进入临床阶段。

参考资料
1、各公司官网
2、公众号:动脉新医药、风气药界、干细胞者说

 产业资讯
产业资讯
 医药投资部落
医药投资部落  2025-05-02
2025-05-02
 52
52

 产业资讯
产业资讯
 赛柏蓝
赛柏蓝  2025-05-02
2025-05-02
 52
52

 产业资讯
产业资讯
 瞪羚社
瞪羚社  2025-05-01
2025-05-01
 133
133