 产业资讯
产业资讯
 研发客
研发客  2023-07-17
2023-07-17
 3536
3536
被Perlmutter及其公司Eikon收入囊中的博迪生物的TLR7/8受体激动剂,已经看到疗效且安全性良好;英派药业的高选择性PARP1选择性抑制剂,预计可在人体达到很高的暴露量和更好的安全性,应用空间广阔,即将提交IND。
两家中国药企——博迪生物(Seven and Eight Biopharmaceuticals)和英派药业的在研项目,尽管尚处在早期阶段,但因为差异化特色,而吸引了行业大咖Roger Perlmutter的注意,将其收入囊中,合作推进临床开发。
在制药界,Roger Perlmutter鼎鼎大名。他曾在默沙东工作12年,并担任执行副总裁和默克实验室(Merck Research Laboratories)总裁,领导了包括K药(Keytruda)在内的多款重要产品的研发。此外,他还在安进担任执行副总裁和研发主管多年。
2021年,美国加州的生物技术初创公司Eikon Therapeutics宣布,Perlmutter加入该公司并担任CEO。Eikon成立于2019年,据其网站,该公司的研发平台基于联合创始人Eric Betzig所发明的超分辨率荧光显微镜,Betzig因此获得了2014年的诺贝尔化学奖。
Perlmutter曾公开解释了Eikon这一前沿技术:“使用超分辨率显微镜,我们可以追踪单个分子。也就是说,我们可以在任何单个蛋白分子上放置荧光探针,计算荧光探针的位置,并且看到活细胞内部的单个蛋白,分辨率可以达到10亿分之1米。”Perlmutter表示,“Eikon的首要目标是发现和开发重要的新药”,他相信,通过超分辨率显微镜以及公司软件团队藉此所获得的海量数据,“不仅可以识别出药物靶点,还能识别出已知靶点但尚未发现的药物”。不过,截至目前,Eikon尚未公布任何在研产品的信息。
刚刚过去的6月1日,Eikon宣布获得了近1.06亿C轮融资,将该公司成立以来所获得的融资总额推高至近7.75亿美元。同时,Eikon还宣布从3家公司购入资产,包括博迪生物的两款已进入临床试验阶段的TLR7/8激动剂、英派药业即将提交IND的PARP1选择性抑制剂,以及Cleave Therapeutics的临床前资产。
谈及为何选择从外部购买资产,Perlmutter在接受Fierce Biotech采访时透露,今年初的JPMorgan大会上,Eikon与30多家公司举行了会议,会上有很多公司都愿意与Eikon建立合作伙伴关系。Perlmutter说,“这是一个机会窗口,因为现在人们渴望进来,但以后可能就不会,所以我们现在就做”。
Eikon并未在新闻稿中透露这三笔交易的财务条款,不过Perlmutte表示,价格“在当下的环境下是公平的”。他在采访中将Eikon描述为一家具有竞争力的公司,可以从那些需要国际资源一起开发自己项目的生物技术公司手中接过接力棒。
尽管融资环境更为困难,但Perlmutte认为,Eikon前期获得的资金足够支付新资产的早期临床开发费用。
另一方面,药企愿意与Eikon合作的原因之一是Perlmutter及其团队的学术专业性以及卓越的临床运营能力。合作方博迪生物的CEO 刘华涛博士和英派药业的CEO 蔡遂雄博士在接受研发客采访时,都提到Perlmutter及其搭档——Eikon的CMO、前默沙东默克实验室CMO和全球临床开发负责人 Roy Baynes对项目的独到眼光和执行力。
那么,博迪生物和英派药业这两家中国药企的早期项目,又是凭什么吸引了Perlmutter团队的注意呢?
首款静脉给药且看到临床疗效的TLR7/8
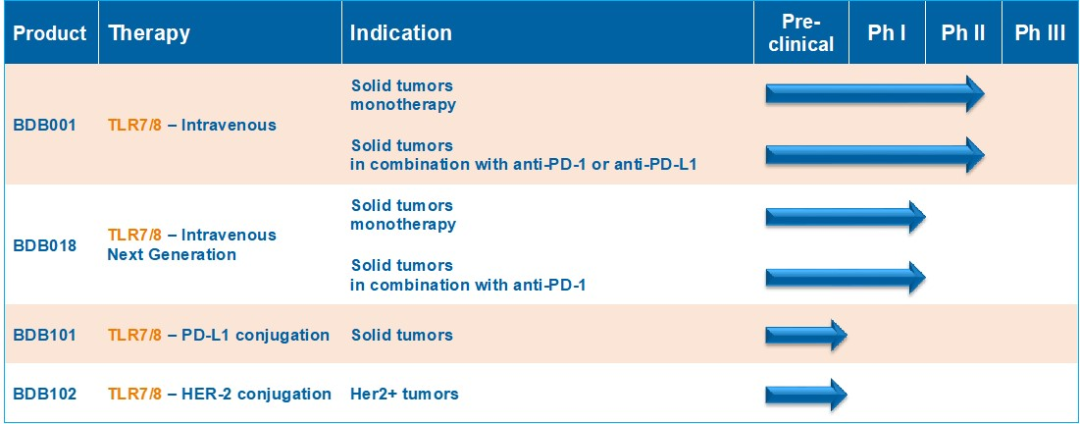
根据新闻稿,Eikon获得了博迪生物两款已经进入临床的Toll样受体(TLR)7/8激动剂BDB001和BDB018,以及尚处在临床前阶段的Toll样受体配体/抗体偶联(TLAC)产品的全球独家权益。
刘华涛告诉研发客,在认真查看了BDB001已经完成的1期研究的每位患者数据后,Baynes主动提出了合作意向。考虑到后续的开发需要大量资金,“他们(Eikon)的决策比较快,我们希望能把这个药做成,所以选择和他们合作”。
看上去Perlmutter和刘华涛的愿望一致。在接受Endpoints采访时,Perlmutter表示,“Roy (Baynes)和他的团队已经设计好了下一组临床试验。原则上,这些试验可以用于注册,但我们还需要与监管机构进行大量的讨论。”
来源|博迪生物官网
刘华涛介绍,TLR是一类重要的受体家族,配体与树突状细胞(DC)上的TLR结合后,可激活特定的细胞内信号级联,从而启动宿主针对病原体和肿瘤细胞的防御反应。近年来的基础科学研究已经证明,使用TLR特异性激动剂可以促进针对肿瘤的免疫结合。其中,TLR7和TLR9在浆细胞样DC(pDC)上表达,而TLR8在髓样DC(mDC)上表达。
之前几款针对TLR9受体的瘤内给药的候选药物,如vidutolimod(CMP-001)、SD-101和tilsotolimod(IMO-2125)在黑色素瘤的治疗上取得不错的疗效,但CpG分子瘤内给药的方式限制了这一类药物在其他实体瘤上的使用。而能同时激活两类DC的TLR7/8抑制剂,如MEDI-9197和NKTR-262都因为安全性问题而停止开发。
“之前药物没有成功,以至于大家认为这类TLR7/8受体激动剂的治疗窗比较窄,多集中在瘤内注射,但激活免疫是系统性的,”刘华涛解释说,“我们研发出的BDB001是首款静脉给药且看到临床疗效的TLR7/8受体激动剂,而且不论是单药还是与抗PD-(L)1联用,都具有很好的安全性。我们在分子的选择上,剂量和给药模式的摸索上下了更多的功夫。 我们认为ADC的潜力也很大。”
安全性良好的高选择性PARP1抑制剂
Eikon还从另一家中国药企英派药业获得了包括IMP1734在内的高选择性PARP1抑制剂中国以外的独家权益。
目前已经有4款PARP抑制剂在全球成功上市。蔡遂雄介绍,这些分子均同时靶向PARP1和PARP2。然而,研究发现,这两个靶点中,PARP1抑制主要与药效相关,PARP2抑制非但与药效关系不大,还导致了血液学毒性。
因此,与第一代PARP抑制剂相比,高选择性PARP1抑制剂可以在人体上达到高很多倍的暴露量且安全性良好,具有很好的应用前景。“最大的用处就是今后可以做很多联合用药,与化疗、靶向药和ADC都可以联用,有可能成为又一个类似PD-1抑制剂类的热门靶点。”蔡遂雄说道。
而对于PARP抑制剂,Perlmutter和Baynes并不陌生。在默沙东时,两人即深度参与了与阿斯利康合作的PARP抑制剂奥拉帕利,以及目前由GSK/强生和再鼎一起销售的尼拉帕利的开发。
此外,Perlmutter还告诉Endpoints,Eikon使用超分辨率显微镜观察了PARP1和PARP2两种蛋白之间的差异,支持了PARP2会导致毒性这个观点。“我们相信,这给了我们一些特别的见解,有助于我们设计开发计划。”Perlmutter说。
蔡遂雄在接受研发客采访时同样提到了这一点。他表示,今年二季度到三季度的时候,公司将在中美提交IMP1734的IND,“在申报IND前,英派希望与国际上有实力的药企达成合作,加速临床开发”。
而英派在多家公司中最后选择Eikon作为合作方的原因,一方面是由于Eikon的“高分辨率显微镜可以帮助更好地开发PARP1抑制剂”,另一方面,Perlmutter及其团队曾经深入参与过PARP抑制剂的开发也是重要的考量因素。

 产业资讯
产业资讯
 智药局
智药局  2025-12-15
2025-12-15
 85
85

 产业资讯
产业资讯
 Medaverse
Medaverse  2025-12-15
2025-12-15
 73
73

 产业资讯
产业资讯
 生物药大时代
生物药大时代  2025-12-15
2025-12-15
 67
67