 医改专题
医改专题
 识林
识林  2023-09-19
2023-09-19
 2529
2529
【创新与临床研究】
9.12,【CDE】关于公开征求《间充质干细胞防治移植物抗宿主病临床试验技术指导原则(征求意见稿)》意见的通知
9.12,【CDE】关于公开征求《罕见病基因治疗产品临床试验技术指导原则(征求意见稿)》意见的通知
9.12,【科技部】关于发布人类遗传资源管理常见问题解答的通知
【CMC与仿制药】
9.14,【药典会】新增大量常用通则标准草案的公示,包括HPLC,炽灼残渣,装量,崩解,溶出等
【注册与审评】
9.11,【NMPA】关于调整麻醉药品和精神药品目录的公告(2023年第120号)
【GMP与生产】
9.7,【中国医药设备工程协会】《无菌药品生产污染控制策略技术指南 (征求意见稿)》发布,公开征求意见
9.12,【福建省】关于印发《福建省药品生产日常监督管理办法》的通知
9.12,【福建省】关于印发《福建省药品生产质量管理规范符合性检查工作程序》的通知
【政策法规综合】
9.6,【NMPA】新增18篇对全国人大代表和政协委员建议提案回复,包括儿童药,境外转境内,改良新等等业界重点议题
【新药批准和报产】
9.11-9.17,NMPA发布4个新药批准,CDE受理7个NDA
【创新与临床研究】
9.12,【CDE】关于公开征求《间充质干细胞防治移植物抗宿主病临床试验技术指导原则(征求意见稿)》意见的通知
移植物抗宿主病(graft-versus-host disease, GvHD)是异基因造血干细胞移植术后并发症和非复发性死亡的主要原因,防治 GvHD 对保证移植成功及移植后长期生存有重要意义。间充质干细胞治疗 GvHD 的临床试验进展较为迅速。目前国内外无相关的临床试验技术指导原则,为提供关于间充质干细胞防治移植物抗宿主病临床试验的建议,提高相关产品的研究和申报效率,尽快满足患者的临床需求,CDE生物制品临床部起草了本指导原则。本指导原则并非直接借鉴国外已发布的指导原则,主要围绕临床试验的考虑及建议进行阐述,申办者可以依据研发目的在开展间充质干细胞防治移植物抗宿主病临床试验时参考。
9.12,【CDE】关于公开征求《罕见病基因治疗产品临床试验技术指导原则(征求意见稿)》意见的通知
CDE的起草思路,首先在概述部分介绍撰写背景和目的,然后阐述针对罕见病的疾病自然史和生物标志物的一般考虑,临床试验设计要点部分,对罕见病基因治疗产品开展临床试验的受试人群、受试者、研究设计、给药方案、有效性评价、安全性评价统计假设、免疫原性研究、药代动力学研究、药效学研究、合并用药等方面进行指导。最后从基因治疗产品开展罕见病临床试验总体考虑、特殊人群的考虑、临床试验设计角度考虑对风险管理提出建议。本指导原则将结合罕见病特征、基因治疗产品特征,对罕见病基因治疗产品的临床研发提出建议,为罕见病基因治疗产品开展临床试验提供参考。
9.12,【科技部】关于发布人类遗传资源管理常见问题解答的通知
科技部行政审批受理窗口针对《人类遗传资源管理条例实施细则》(以下简称“《实施细则》”)发布以来申请人在办理人类遗传资源行政审批和备案等事项时咨询的常见问题,凝练形成了《人类遗传资源管理常见问题解答》,供申请人在申报过程中进行参考。需注意,往期发布的常见问题(由“版本历史”可知,分别发布于2022年3月和4月)解答同时作废。共计四个部分,30个问题:一、采集、保藏行政许可二、国际合作行政许可与备案三、信息对外提供或开放使用事先报告四、其他问题
【CMC与仿制药】
9.14,【药典会】新增大量常用通则标准草案的公示,包括HPLC,炽灼残渣,装量,崩解,溶出等
国家药品标准提高课题拟立项目录公示(2023年度第二批)关于药品包装用塑料容器及组件相关11个通则标准草案的公示关于苯甲酸苄酯药用辅料标准草案的公示关于0512 高效液相色谱法标准草案的公示关于0542 毛细管电泳法标准草案的公示关于0923 片剂脆碎度检查法标准草案的公示关于0931 溶出度与释放度测定法标准草案的公示关于0940 单位剂量均匀性检查法标准草案的公示关于0921 崩解时限检查法标准草案的公示关于0942 最低装量检查法标准草案的公示关于0841 炽灼残渣检查法标准草案的公示关于不确定度评定指导原则标准草案的公示关于分析仪器确证指导原则标准草案的公示关于0400光学分析法标准草案的公示关于扫描电子显微镜法标准草案的公示
【注册与审评】
9.11,【NMPA】关于调整麻醉药品和精神药品目录的公告(2023年第120号)
根据《麻醉药品和精神药品管理条例》有关规定,国家药品监督管理局、公安部、国家卫生健康委员会决定调整麻醉药品和精神药品目录。现公告如下:一、 将泰吉利定列入麻醉药品目录。二、 将地达西尼、依托咪酯(在中国境内批准上市的含依托咪酯的药品制剂除外)列入第二类精神药品目录。三、 将莫达非尼由第一类精神药品调整为第二类精神药品。本公告自2023年10月1日起施行。
【GMP与生产】
9.7,【中国医药设备工程协会】《无菌药品生产污染控制策略技术指南 (征求意见稿)》发布,公开征求意见
团体标准是官方法规指南的有效补充,识林的“行业协会”页面专门收录重要协会的实用团体标准。此次中国医药设备工程协会发布意见稿指导企业实践CCS,正是行业热点和难点。针对目前企业在制定污染控制策略时所存在的各控制和监测措施如何有机结合、现有控制和监测方式的有效性如何评估、污染控制策略如何与现有质量体系协同作用等难点,本指南,旨在为业界提供药品生产过程中污染控制策略的设计、实施、评估和管理的相关指导,帮助业界企事业单位和人员理解污染控制策略的理念,更加有效地建立和实施污染控制策略。本指南为药品生产企业、厂房设施设计单位、设备制造商等提供技术参考,不具有强制性。本指南适用于无菌药品的微生物、热原/内毒素和微粒的污染控制实践,不涉及交叉污染的相关要求。非无菌药品不在本指南的讨论范围内,但对其进行污染控制改进时可作参考。
9.12,【福建省】关于印发《福建省药品生产日常监督管理办法》的通知
本办法所称药品生产日常监督管理,是指药品监督管理部门对药品生产单位的生产(含配制,下同)条件、生产过程和质量管理等,依法履行监管职责所进行的监督检查、抽检、监测、行政处罚等监督管理活动。文中,福建省局在多个企业关注热点上给出相当明确的监管措施,站在企业角度,也未尝不是一种支持。
规定可以委托检验的情形有哪些?报告的时限和要求?
对质量受权人(质量管理负责人)管理提出了哪些要求?
规定停产报告的情形有哪些?报告的时限和要求?
规定仓储、公用系统、质量控制实验室变更报告的情形有哪些?报告的时限和要求?
药品监督管理部门根据监督检查情况综合判定的检查结论有哪些,针对不同检查结论分别采取哪些措施?
9.12,【福建省】关于印发《福建省药品生产质量管理规范符合性检查工作程序》的通知
《工作程序》共5章34条。主要内容包括:一是明确定义和适用范围。明确GMP符合性检查及其各个分类的定义,列出各类别的申请情形,适用于福建省内GMP符合性检查的申请/发起、检查和结果处理。二是厘清部门职能分工。对省局药品生产处、稽查办及省核查中心的职能进行梳理,要求在各自职责范围内承担相关工作。省核查中心负责《工作程序》中各种GMP符合性检查的具体实施。三是规范检查工作程序。明确各类别检查的情形、检查程序、检查方式、检查时限、结果认定、缺陷整改要求及结果公开方式等相关内容。四是指出简化程序情形。明确豁免、优先及优化检查的情形,并建立沟通交流机制,对申请人无法确定是否要申请药品GMP符合性检查的,可向省局申请沟通交流。
【政策法规综合】
9.6,【NMPA】新增18篇对全国人大代表和政协委员建议提案回复,包括儿童药,境外转境内,改良新等等业界重点议题
在学习运用法规指南之余,NMPA发布的提案回复函也颇有价值,不仅可以看出当今业界最为关心的诉求,也能从药监部门(以及会同回复的部委)的政策导向。识林专门建立“政策法规 > 国内药监 > 法规文件 > 工作文件”,收集此类函件,供用户参考。此次更新总计18篇,涉及议题如下:张懿宸委员:《关于推动儿童药高质量发展的提案》欧阳华代表:关于进一步优化境外生产药品转移至境内生产的政策规章、推动生物医药产业高质量发展的建议杜振兴等代表:关于将特医食品统一收费编码和加强特医食品监管,推进特医食品临床应用的建议李玉梅代表:鼓励改良型新药创新发展的建议李思进委员:《关于加快临床价值明确药品参比制剂发布的提案》谢红委员:《关于加快对临床价值明确、无参比制剂类儿童用药产品审评审批的提案》蓝景芬代表:关于创新发展传统民族医药大力推动浙西南畲医药产业高质量发展的建议杜薇代表“关于推动贵州民族医药列入中华人民共和国药典的建议”徐兰宾代表:“关于推进国家区域医疗中心院内特色制剂跨省流通的建议”韩琳代表:关于完善中药配方颗粒相关政策的建议郑喆轩代表:关于科学制订和规范执行中药配方颗粒相关政策,促进中药产业健康持续发展的建议孙达委员:《关于加快推进中药配方颗粒国标制定,规范中药配方颗粒备案机制的提案》姚卓匀代表:关于加快建设视障人士安全用药无障碍环境的建议陈玮代表:关于推动国产HPV疫苗加速上市的建议张海军代表:关于引导生物医药医疗器械产业走出国门参与国际循环的建议袁玉宇代表:关于允许高性能医疗器械研发真实性核查前置的建议马一德代表:关于以RCEP实施为契机,推动我国创新药走出去的建议马永平代表:关于提升公众医药知识水平,加强人民维护健康能力的建议
【新药批准和报产】
9.11-9.17,NMPA发布4个新药批准,CDE受理7个NDA
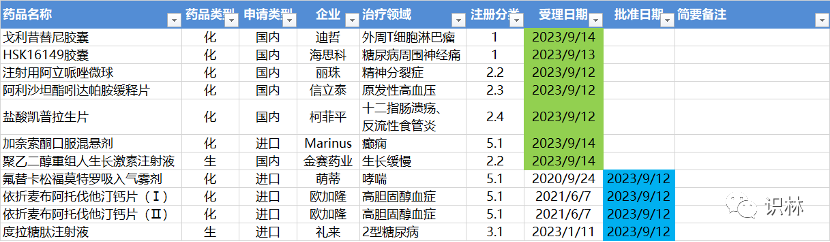
注:仅列出新药(包括改良型新药和生物类似药)的上市申请和批准上市信息。在“以临床价值为导向”的背景下,申请上市以及获批的品种,其适应症、临床研究策略、注册路径,都值得业界关注和分析。

 医改专题
医改专题
 财联社
财联社  2025-08-07
2025-08-07
 35
35

 医改专题
医改专题
 风云药谈
风云药谈  2025-08-06
2025-08-06
 47
47

 医改专题
医改专题
 中国医疗保险
中国医疗保险  2025-08-05
2025-08-05
 80
80