 产业资讯
产业资讯
 医药魔方Info
医药魔方Info  2023-11-17
2023-11-17
 2432
2432
短短十年间,中国医药行业发生了翻天覆地的变化。如今,我国不仅已经成为全球第二大医药市场,本土企业在国际上的竞争力也日益提高,从原料到仿制药再到创新药,成功出海的案例不胜枚举。
据不完全统计,目前我国已有6款新药(包括创新药和改良型新药)率先登陆美利坚,赚起了美元。此外,百奥泰开发的生物类似药也于近日拿到了进入全球市场角逐的FDA批准门票。
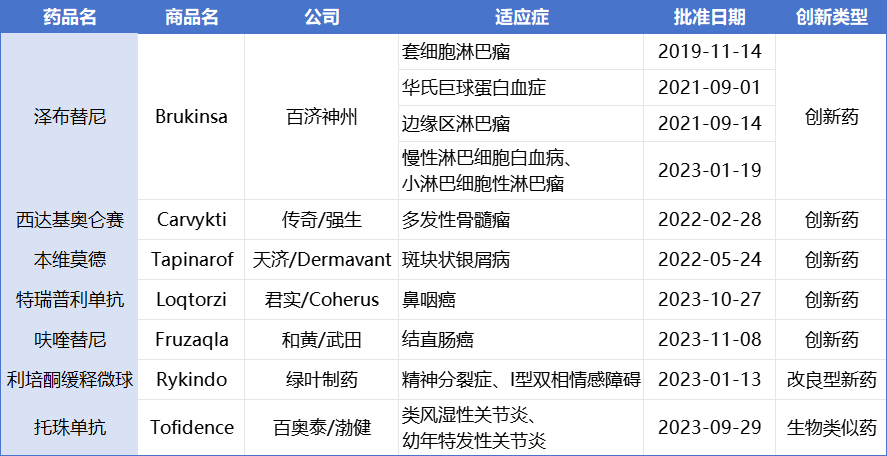
具体来说,泽布替尼是由百济神州开发的一款BTK抑制剂,2019年11月获FDA加速批准用于治疗既往接受过至少一项疗法的成年套细胞淋巴瘤患者,成为我国首款在FDA闯关成功的创新药。
2022年,泽布替尼凭借头对头III期临床研究成功证明了自己的best-in-class潜力。随着产品疗效认可程度的加深和新适应症的拓展,2023年前三季度泽布替尼的销售额已经达到了8.77亿美元,年底将成功跻身十亿美元分子俱乐部。
西达基奥仑赛是由传奇生物开发的一款BCMA CAR-T细胞疗法。2022年3月,在强生的助力下,西达基奥仑赛获FDA批准用于治疗复发/难治性多发性骨髓瘤(r/r MM)患者,成为首款在美上市的国产CAR-T细胞疗法。
市场表现方面,今年前三季度,西达基奥仑赛合计销售3.41亿美元。强生预测该产品全年销售额将突破5亿美元,明年有望突破10亿美元。
本维莫德是由天济医药开发的一款每日1次的治疗性芳香烃受体调节剂(TAMA),2022年5月获FDA批准用于成人斑块型银屑病的局部治疗。该款产品是FDA批准的同类中首个无类固醇的外用药物,也是美国25年来首款获批治疗银屑病的外用新分子实体药物。(见:25年来首款!国产1类银屑病新药「本维莫德乳膏」获FDA批准上市)
特瑞普利单抗是由君实生物开发的一款PD1单抗,今年10月底获FDA批准上市,联合吉西他滨/顺铂一线治疗晚期复发或转移性鼻咽癌患者,或单药用于复发或转移性鼻咽癌含铂治疗后的二线及以上治疗。这是国内首款突围成功在美上市的PD1单抗。
呋喹替尼是由和黄医药开发的一款选择性口服VEGFR-1、-2及-3抑制剂,本月刚获FDA批准用于治疗经治成人转移性结直肠癌患者。这是十年来美国批准的首个用于转移性结直肠癌的靶向疗法, 无论患者的生物标志物状态或既往的治疗种类如何。利培酮缓释微球是绿叶制药开发的一款长效注射药物,今年1月获FDA批准用于治疗精神分裂症成人患者、以及作为单药或作为锂盐或丙戊酸盐的辅助疗法用于双相障碍I型成人患者的维持治疗,成为首个由中国药企自主研发并在美国获批上市的中枢神经系统(CNS)治疗领域的新药,也是首个根据505(b)(2)条款获得FDA批准上市的国产复杂制剂产品。
除以上7款已经在美上市的产品外,目前,替雷利珠单抗、卡瑞利珠单抗、曲妥珠单抗(汉曲优)等产品也正在排队等待FDA最后的审批。
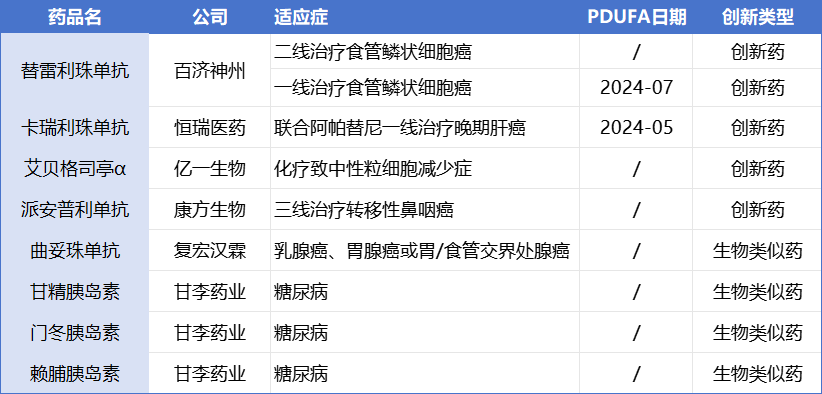
其中派安普利单抗、替雷利珠单抗和卡瑞利珠单抗都是PD1单抗,但后两款产品与特瑞普利单抗打法明显不同,分别瞄准了食管鳞状细胞癌、肝癌两大适应症。近日,百济神州在三季度报中透露,替雷利珠单抗二线治疗ESCC成人患者有望于今年内或明年上半年获得FDA批准,此外今年还将向FDA递交一线治疗胃癌的新适应症上市申请。
根据康方生物新闻稿,派安普利单抗是在2021年5月通过实时肿瘤审评(RTOR)途径提交的生物制品许可申请(BLA),具体适应症为三线治疗转移性鼻咽癌。
在竞争激烈的创新药环境中,每个药企都渴望成为那个能够撞开第一大医药市场——美国大门的人。近两年,虽然全球生物医药行业处于下行周期,但不管是通过自主出海,抑或是通过造船出海、联合出海的方式,我国本土企业自主开发的创新药、改良型新药、生物类似药在这方面仍取得了突破性进展。

 产业资讯
产业资讯
 医药财经
医药财经  2025-10-14
2025-10-14
 418
418

 产业资讯
产业资讯
 医药魔方Invest
医药魔方Invest  2025-10-14
2025-10-14
 425
425

 产业资讯
产业资讯
 同写意
同写意  2025-10-14
2025-10-14
 407
407