 产业资讯
产业资讯
 医药观澜
医药观澜  2023-12-01
2023-12-01
 1440
1440
11月30日,中国国家药监局药品审评中心(CDE)官网公示,罗氏(Roche)申报的mosunetuzumab(RO7030816)拟纳入优先审评,适用于治疗既往接受过至少两种系统性治疗的复发或难治性滤泡性淋巴瘤(FL)成人患者。公开资料显示,这是罗氏的“first-in-class”双特异性抗体疗法Lunsumio,此前已经在欧盟和美国获批用于治疗经过两种或多种前期系统治疗后复发或难治FL成年患者。该产品是一款CD20/CD3 T细胞衔接双特异性抗体,代表着一种无化疗、现货型(off-the-shelf)新免疫治疗选择。
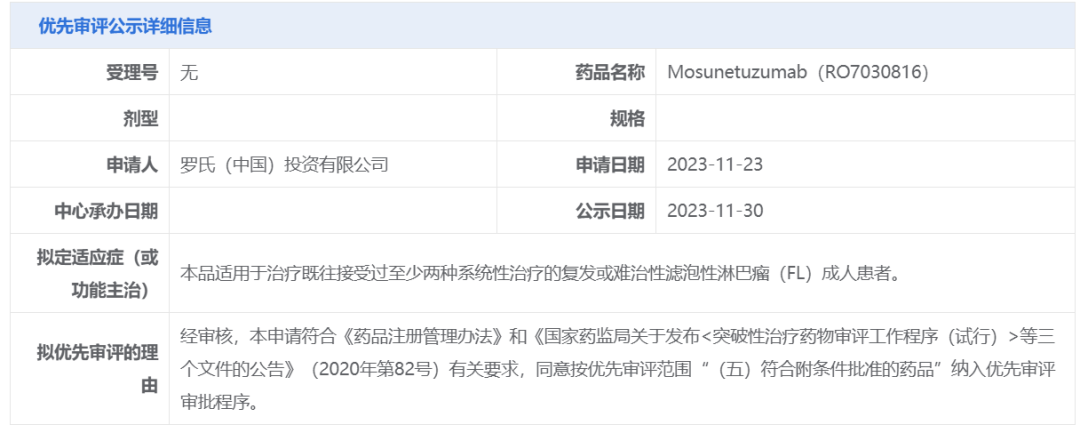
截图来源:CDE官网
公开资料显示,mosunetuzumab是一款靶向B细胞表面的CD20抗原和T细胞表面的CD3受体的T细胞衔接双特异性抗体。它可以引导患者体内的T细胞迁移到目标B细胞附近,并且释放细胞毒性的蛋白消灭B细胞。Mosunetuzumab以静脉输注的形式给药,持续时间固定,允许休息治疗,也可以在门诊输液。此前,该药还曾获FDA授予突破性疗法认定和孤儿药资格。2022年6月,该药在欧盟获批,用于治疗复发/难治性滤泡性淋巴瘤成人患者,他们已经接受过至少两种前期系统治疗。同年12月,该产品获得美国FDA批准,治疗经治复发或难治的FL成年患者。
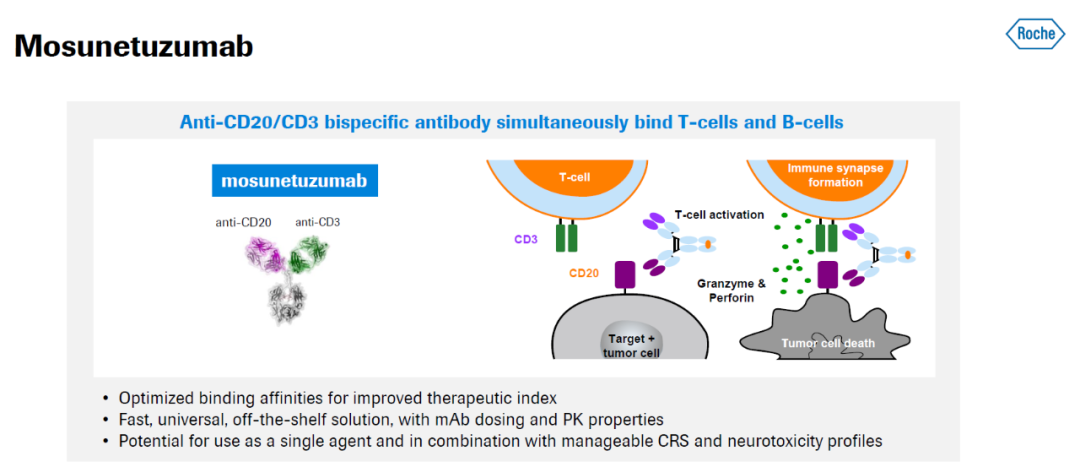
▲Mosunetuzumab的作用机制(图片来源:罗氏官网)
Mosunetuzumab已经在一项2期GO29781研究中取得积极结果,该试验结果显示出该产品对于复发或难治滤泡性淋巴瘤患者具有较高且持久的应答率。在接受mosunetuzumab治疗的患者中,80%的患者出现了客观反应(包括完全反应和部分反应),大多数患者至少18个月内保持了反应(57%)。应答者的中位应答持续时间接近2年。60%的患者获得完全反应(CR)。在218名接受推荐剂量mosunetuzumab治疗的血液系统恶性肿瘤患者中,最常见的不良事件(AE)是细胞因子释放综合征(CRS;39%),CRS事件的中位持续时间为3天。其他常见AE包括疲劳、皮疹、发热和头痛。
据GO29781研究研究者Elizabeth Budde博士早先曾在新闻稿中表示,这一批准对复发或难治性滤泡性淋巴瘤患者来说是一个重要的里程碑,他们迄今为止的治疗选择有限。作为一种可在门诊环境中启动的T细胞结合双特异性抗体,mosunetuzumab的高应答率和固定持续时间可能会改变晚期滤泡性淋巴瘤的治疗方式。
参考资料:
[1]中国国家药监局药品审评中心(CDE)官网.Retrieved Nov 30,2023, From https://www.cde.org.cn/main/xxgk/listpage/2f78f372d351c6851af7431c7710a731
[1]FDA Approves Genentech’s Lunsumio, a First-in-Class Bispecific Antibody, to Treat People With Relapsed or Refractory Follicular Lymphoma. Retrieved Dec 22 , 2022. From https://www.gene.com/media/press-releases/14978/2022-12-22/fda-approves-genentechs-lunsumio-a-first

 产业资讯
产业资讯
 医药投资部落
医药投资部落  2025-05-02
2025-05-02
 4
4

 产业资讯
产业资讯
 赛柏蓝
赛柏蓝  2025-05-02
2025-05-02
 5
5

 产业资讯
产业资讯
 瞪羚社
瞪羚社  2025-05-01
2025-05-01
 89
89