 产业资讯
产业资讯
 识林
识林  2024-01-11
2024-01-11
 2229
2229
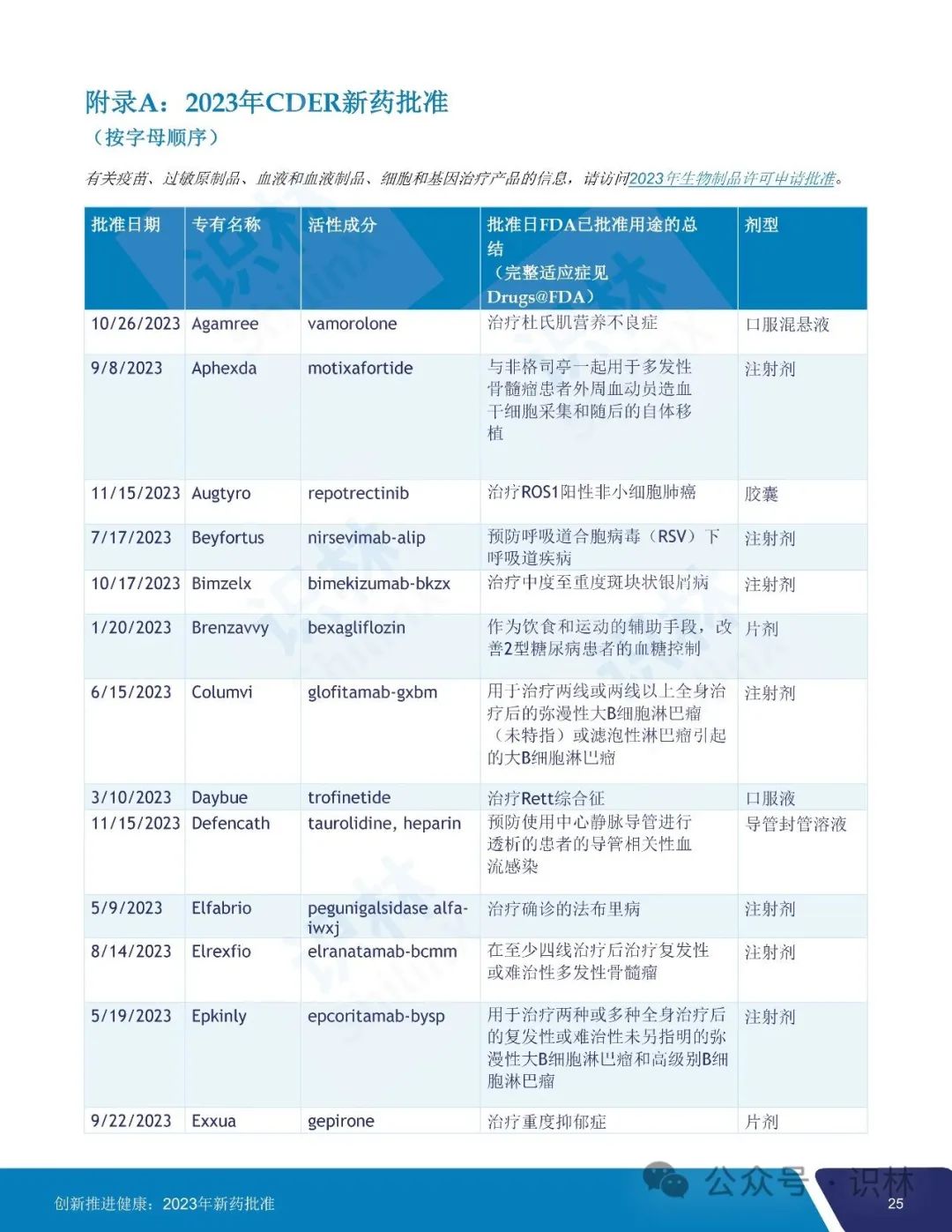
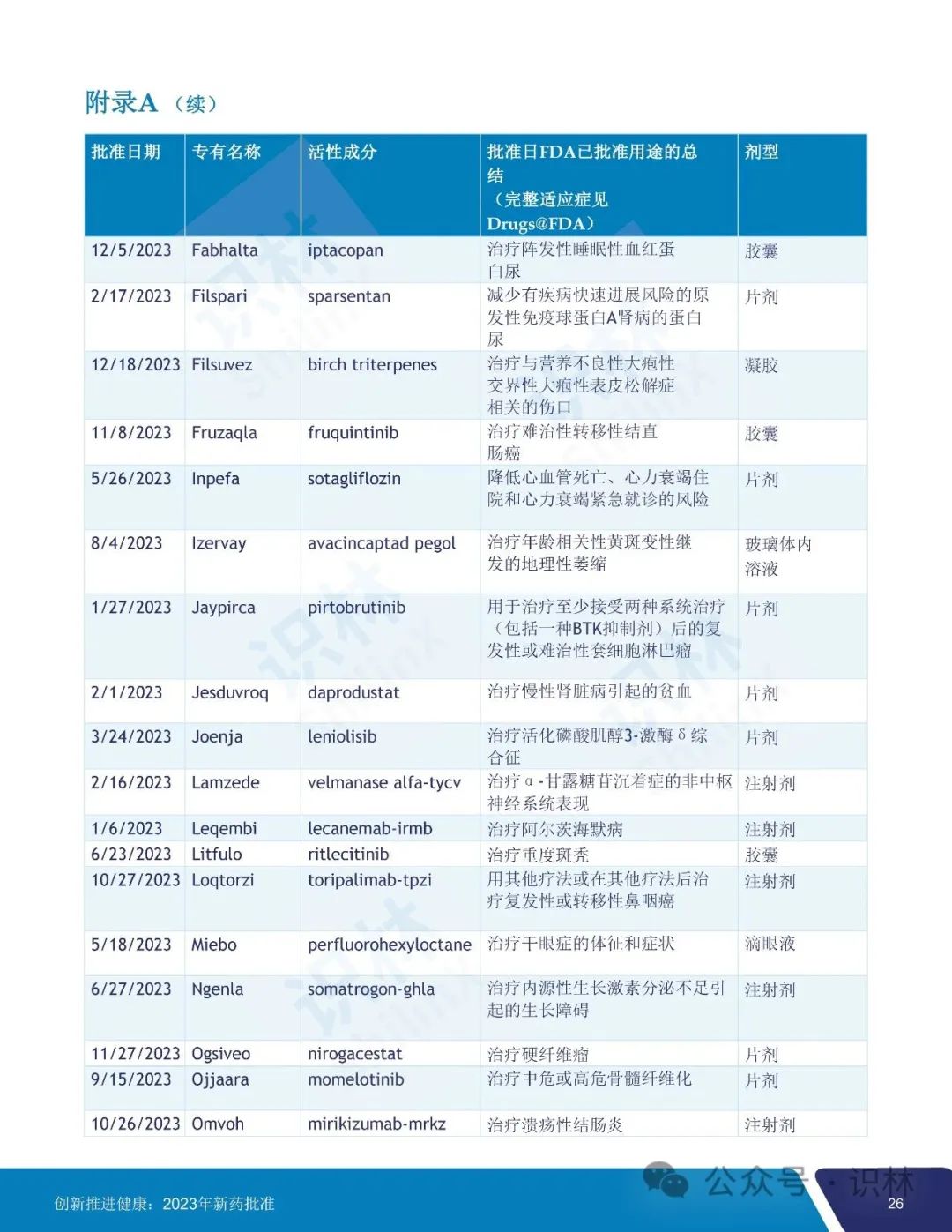
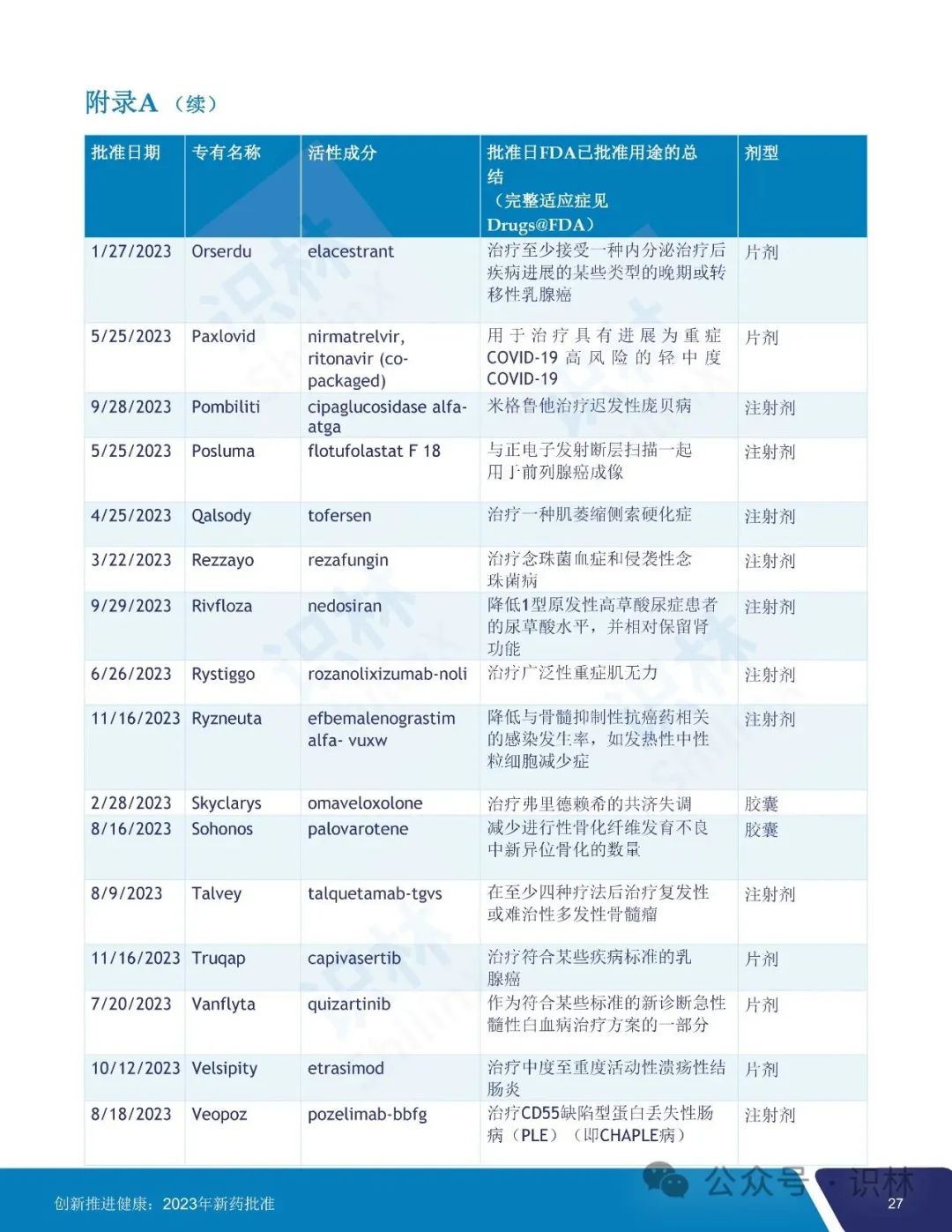
美国 FDA 于 2024 年 1 月 8 日发布了其 2023 年度 FDA 新药审批总结报告。报告汇总了 FDA 药品审评与研究中心(CDER)去年一年中批准的所有新药、新用途和新使用人群以及生物类似药和可互换生物类似药、新配方和新剂型以及儿科人群扩展,概述了一系列值得注意的批准,提供了许多 CDER 批准的新治疗药物促进患者健康的有价值实例。
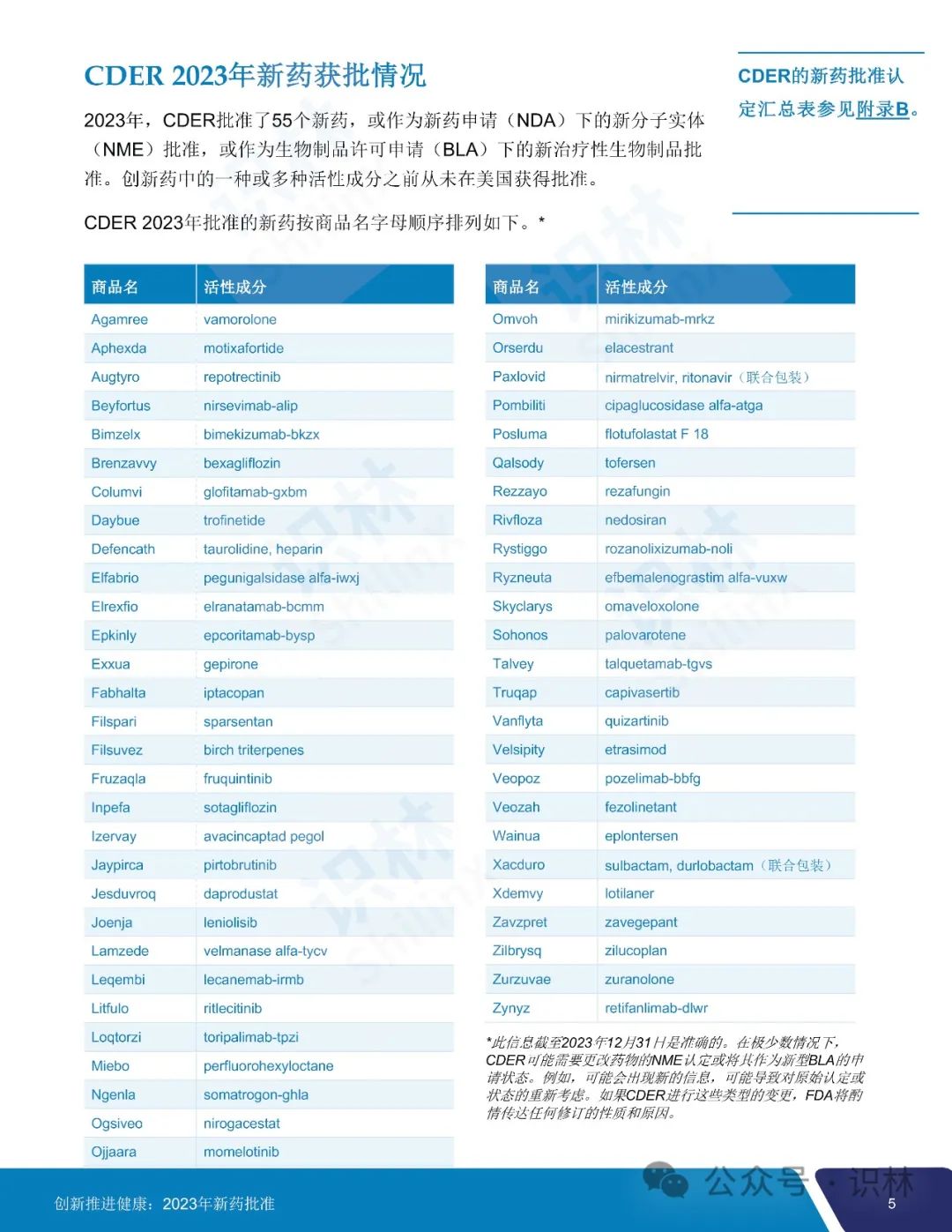
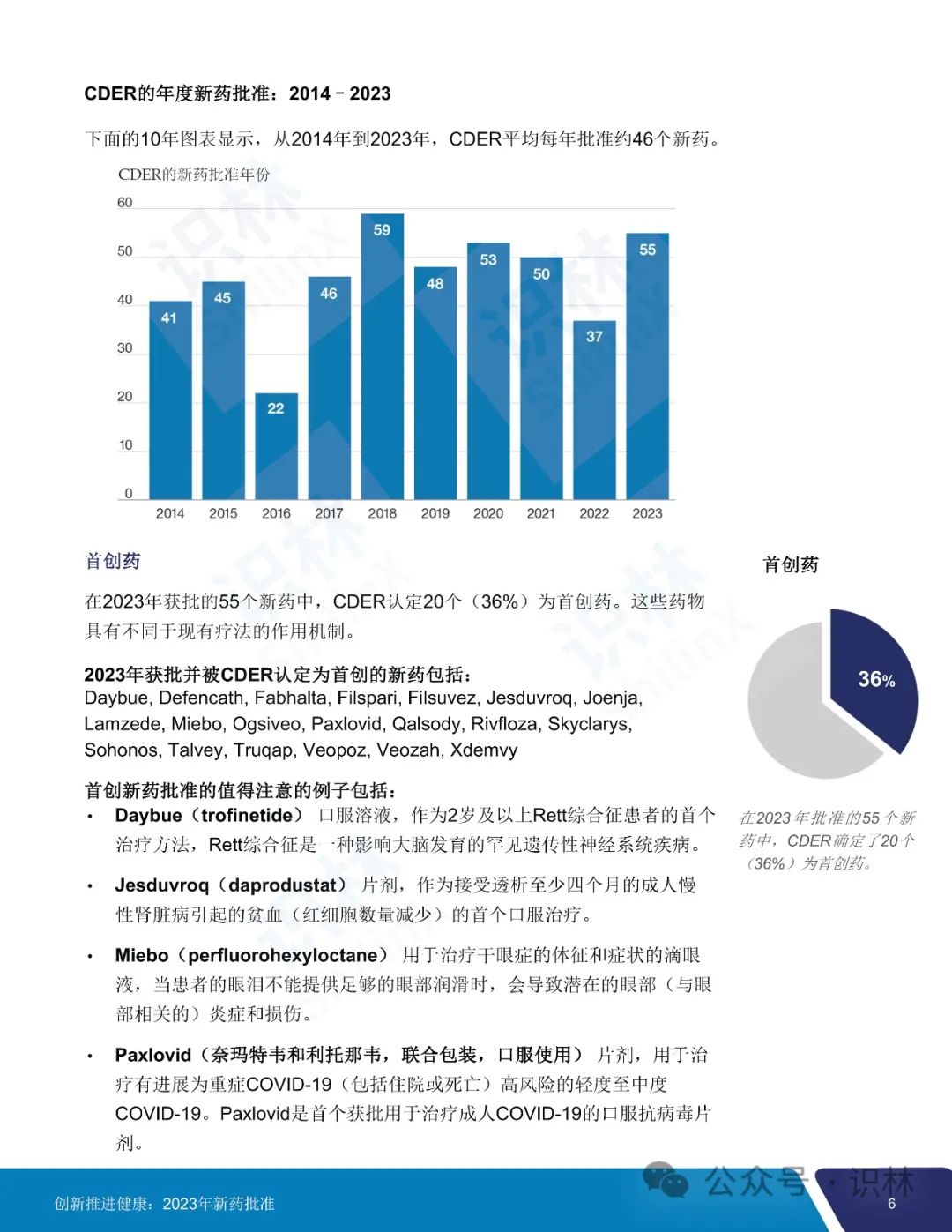
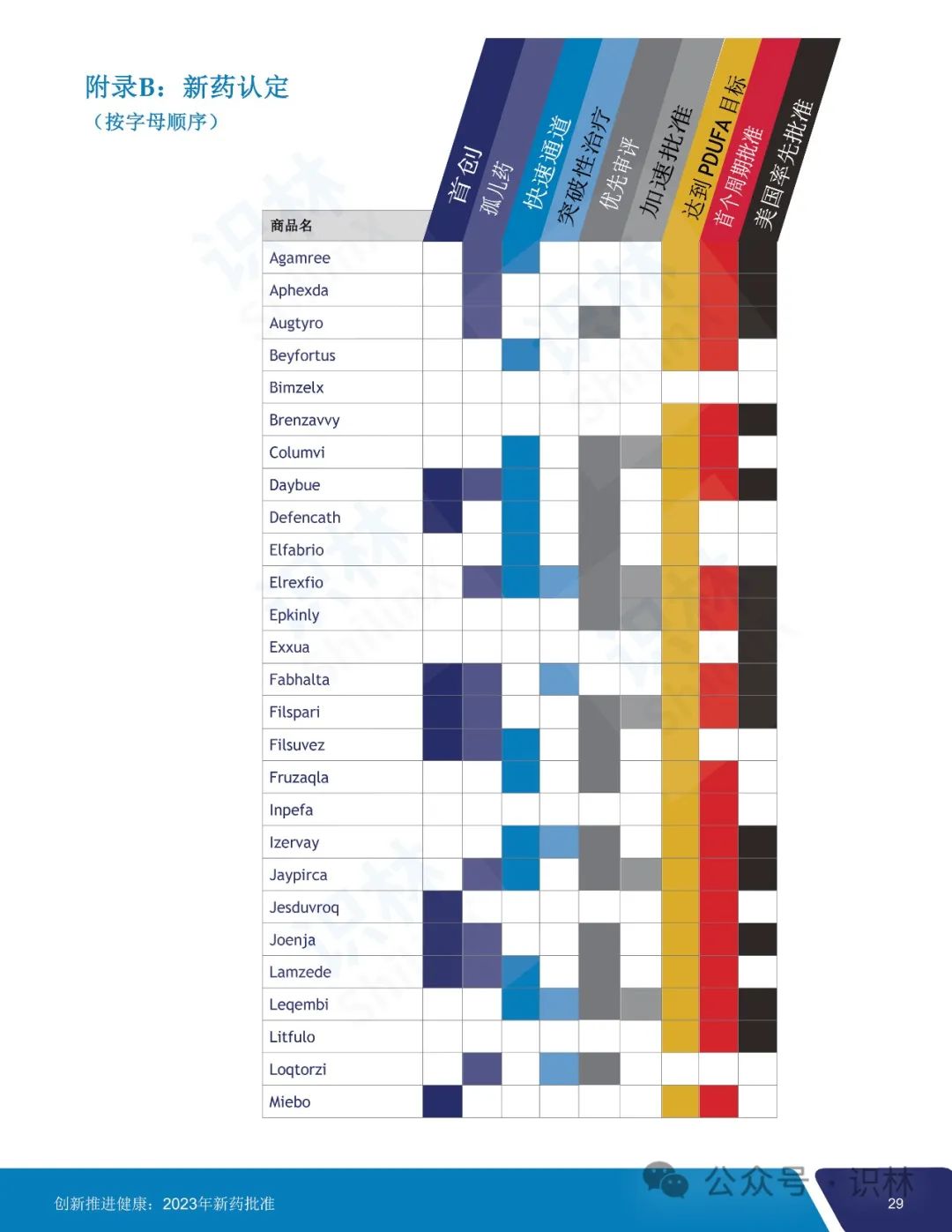
2023 年 CDER 共批准了 55 个新药,其中 20 个(36%)首创新药,28 个(51%)罕见病用药。
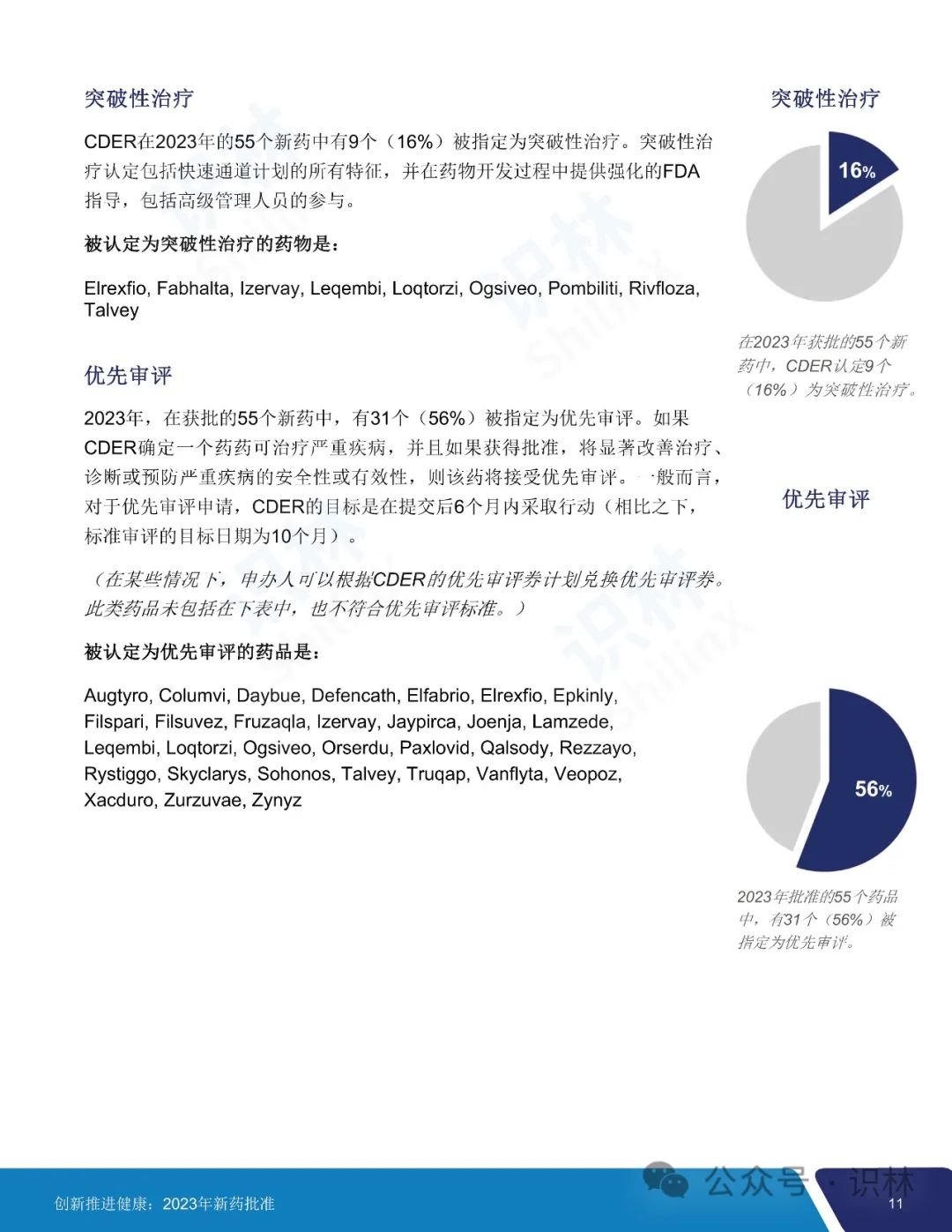
55 个获批新药中,25 个(45%)被认定为快速通道,9个(16%)被认定为突破性治疗药物,31 个(56%)被认定为优先审评,9个(16%)获得加速审批。CDER 对 2023 年批准的所有新药中的 36 个(65%)使用了一项或多项加快开发和审评方法。另外,批准的 55 个新药中,46 个(84%)首轮获批,35 个(64%)先于任何其它国家在美国获批。
识林对报告内容做了全文翻译如下,供大家阅览。

























 产业资讯
产业资讯
 医药魔方Info
医药魔方Info  2025-07-21
2025-07-21
 7
7

 产业资讯
产业资讯
 识林
识林  2025-07-21
2025-07-21
 6
6

 产业资讯
产业资讯
 研发客
研发客  2025-07-21
2025-07-21
 8
8