 产业资讯
产业资讯
 医药魔方Invest
医药魔方Invest  2024-02-02
2024-02-02
 1562
1562
2024年开年,FDA的一纸公文,掀起了CAR-T行业不小的波澜。
1月22日,FDA发布公告称,要求已上市的6款CAR-T细胞疗法的开发商在处方说明书上标注黑框警告,提醒靶向BCMA或CD19的自体CAR-T细胞免疫治疗后患者有T细胞恶性肿瘤的风险,并表示6家药企必须在未来30天内提交拟议的标签变更,如果不同意,企业可以提出反驳,解释为什么不需要增加黑框警告。
此消息一出,市场对“天价药”CAR-T商业化的担心,被无限放大,最终体现在了诺华、BMS等多家药企的股价下跌,港股中的CAR-T概念股也受到波及。
然而,拨开市场情绪的迷雾,不少业内人士认为此番“黑天鹅”事件无需惊慌,尤其是在FDA未进一步出指导原则前,此事对CAR-T行业影响并不大,也远未到改变“游戏规则”的程度。
黑框警告有多严重?
“减肥的GLP-1药物,自免的JAK抑制剂,奥马珠单抗都有黑框警告,何须担心CAR-T这种后线肿瘤药?” 一位资深医疗领域投资人接受医药魔方Invest采访时直言。
事实上,过去有诸多案例都表明了标注黑框警告并不意味着药物被“打入冷宫”。不少畅销药物乃至曾经的“药王”修美乐,皆是带着黑框警告每年在全球创收数十亿甚至数百亿美金。
EvaluatePharma的《EP Vantage 2018 Preview》报告就曾指出,2018年全球最畅销的10款药物中,有8款都有黑框警告。
回到2023年研发和BD十分火热的ADC领域,目前全球已上市的15款ADC药物中,亦有10款具有黑框警告,包括名声大噪的DS-8201,其黑框警告是关于引发间质性肺炎风险的提醒。
“GLP-1药物,之所以有关于甲状腺癌潜在风险的黑框警告,是因为在啮齿类动物体内发现有相关数据,但FDA和欧盟都尚未发现在人体内存瘤的证据。”上述资深医疗领域投资人补充说道。
黑框警告究竟为何?其实黑框警告最早被美国FDA所采用,其会出现在药品说明书最靠前的位置,代表该药物具有引起严重的、甚至危及生命的不良反应的重大风险。由于这是FDA所能做出的对上市药品最严厉的警告,也导致了不少人会谈虎色变。
驯鹿生物相关负责人在接受医药魔方Invest采访时解释:“在医疗领域,充分的信息披露和警示是至关重要的。黑框警告,它的目的是起到风险提示,确保医生和患者在做出决策前,能够知悉相关潜在风险。这并不意味着CAR-T疗法本身存在问题。驯鹿生物在研和商业化产品的使用患者中,未观察到T细胞肿瘤案例。”
另外,一位业内人士也表示,美国法律特别重视风险揭示,所以FDA和药企需要把所有风险揭示清楚,否则容易引发患者诉讼,药企将面临巨额赔偿的法律风险。因此,美国FDA要求添加黑框警告已经是一种常态,这对监管机构和药企都起到一种保护作用。美国的医生和患者对黑框警告的意义也非常了解,在使用之前会作出理性判断,不会过分恐慌。
黑框警告会影响Car-T商业化吗?
然而,当短时间内消息铺天盖地而来,人们对黑框警告的认知不足,导致了对CAR-T商业化的再次质疑。
对此,源津创投创始合伙人万津和国投创业投资总监钟靖都给出了相同的观点,即“长期来看,本次事件对CAR-T的商业化影响并不大。”
国内的一家细胞疗法上市公司科济药业也回应称,“公司在研CAR-T产品,临床试验治疗患者总数超过500例,其中靶向BCMA CAR-T产品250余例,未观察到T细胞肿瘤案例。我们认为,这次事件对公司产品的研发和商业化进程没有实质影响。对于此事会持续观察。”
源津创投万津分析,黑框警告是否会较大程度影响药物商业化,与多种因素相关,如适应症需要治疗的迫切性,不良事件在真实世界发生率,医生对药物使用的经验程度等。
上述资深医疗领域投资人举例称:“对于比如像治疗慢性炎症的这类药物而言,涉及面广的黑框警告对它的商业化才会带来很大影响。”
但对于6款CAR-T疗法而言,显然并非如此。源津创投万津表示:“它们的目标大部分是B细胞淋巴瘤,多发性骨髓瘤的末线患者,并无其他有效治疗手段,治疗需求是非常迫切的。”
不过,在国投创业钟靖看来,眼下的黑框警告还是次要问题。“CAR-T商业化难的关键还是在于其自身高昂的价格,实体瘤药效,而并非黑框警告。如何降低成本,如何做到更好的实体瘤药效才是核心问题所在。如果解决了这些问题,CAR-T的市场会显著的打开。”他说。
同样的逻辑也适合往往前线治疗阶段推进的CAR-T疗法。
眼下,市面上已有不少CAR-T企业在探索将CAR-T疗法往一线等更早期的治疗阶段推进——2022年,初代疗法Yescarta已率先撞线二线适应症,BMS的Breyanzi紧随其后,3个月后也获FDA批准用于二线治疗成人大B细胞淋巴瘤(LBCL)患者。
除此之外,诺华的Kymriah、BMS的Abecma和传奇生物/强生的Carvykti也在二线开发上做了尝试。再往更早期看,Kymriah、Abecma、Yescarta和Carvykti则都在探索一线治疗的可行性。
对此,上述资深医疗领域投资人也是一针见血指出,CAR-T疗法的价格就限制了其往一线治疗阶段推进,除非治疗费用能够下降。短期内,往一线治疗推进的CAR-T疗法在后续开发上,很难受到黑框警告的影响。
异体CAR-T迎来新机会?
单从此次黑框警告事件出发,上述受访者都表示很难断言异体CAR-T就会因此有更好的机会。
由于FDA要求标注的信息涉及“自体CAR-T细胞免疫治疗”,有关“异体CAR-T是否有更好的机会?”一度引发业内讨论。
一家专注于开发异体CAR-T的创新药企Allogene Therapeutics,其首席医学官Zachary Roberts在接受外媒采访时就表示,到目前为止,他还没有发现因异体CAR-T导致T细胞恶性肿瘤的病例。
他的解释是,自体和同种异体产品在机制上有所不同。同种异体细胞在体内的存留时间不会太长,通常在治疗后三到六个月就会消失,另外,也可能被宿主免疫系统排斥。
源津创投万津认为,黑框警告一事后,对自体和异体CAR-T的后续研发都会产生较大影响,主要体现在市场对底层技术的改良会更为关注。
FDA的两位官员Peter Marks和Nicole Verdun就在他们的文章中指明,进一步改进CAR结构才是正确的道路。特别是考虑将CAR- T疗法用于血液学和肿瘤学以外的适应症时,采用新策略将CAR构建体靶向插入特定位点可能有助于降低因CAR构建体整合入基因组内致癌位点而引发癌症的风险。
CAR-T将给自免疾病带来变革性影响
而此话也引出了人们对CAR-T疗法拓展至自免赛道的担忧。
源津创投万津认为,对于CAR-T疗法而言,适应症定位非常关键。她分析:“如用CGT治疗现有药物能有效控制的慢性病,其必要性是不足的。”显然,从风险获益比考虑,CAR-T疗法在拓展至自免赛道时仍需辩证看待。
作为国内率先将CAR-T疗法应用于自免领域的生物制药公司,驯鹿生物目前已有两款自免领域适应症IND获批,分别为视神经脊髓炎谱系疾病(NMOSD)和重症肌无力(MG)。
值得注意的是,驯鹿生物瞄准的均是致残、致死率较高的自身免疫性疾病领域,并且此类疾病目前的治疗选择有限,驯鹿生物的CAR-T疗法有望为患者提供新的治疗选择,带来治愈的希望。
而除了适应症选择之外,国投创业钟靖则指出,如果不降低剂量,当前CAR-T疗法拓展至自免赛道仍要解决两个关键问题,一是大部分产品都存在概率不低的神经毒性风险,二是细胞因子风暴。对比来看,“是否致瘤”是次要问题了。
近几年,肿瘤和血液病赛道之外,市场前景更为广阔的自免赛道是诸多CAR-T厂商的优选。
医药魔方NextPharma数据库显示,无论从全球还是中国范围来看,CAR-T在自免领域的临床项目数量已经仅次于肿瘤和血液病,位列第三。
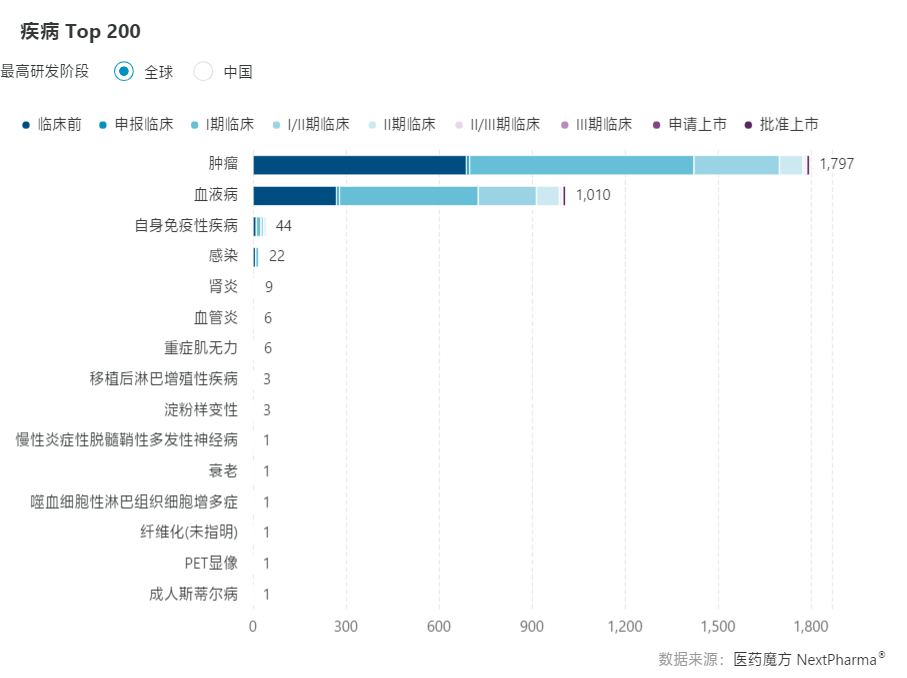
不过,CAR-T进军自免赛道只是刚刚起步。医药魔方NextPharma数据库显示,全球范围里,CAR-T在自免领域的临床项目有超过50%仍处于临床前和临床1期阶段。
尽管道阻且长,驯鹿生物对CAR-T疗法在自免市场的前景依然充满信心,“CAR-T疗法在自免赛道上已经给出一个信号,就是对于自免疾病的治疗而言,CAR-T带来的是变革性的影响。而随着通用CAR-T、CAR-NK,乃至体内递送CAR-T技术逐渐成熟,未来产品的成本会不断下降,企业能拓展更多自免适应症,也将进一步提高产品可及性。”
FDA依旧支持创新疗法
诚然,对于CAR-T这一新兴疗法而言,FDA对6款产品给出黑框警告背后所指的安全性问题,是其快速发展过程中必然会有的质疑和挑战。
况且就此次事件而言,迄今为止,6款获批的CAR-T疗法已在美国各地使用超过27,000剂,但仅有20例左右的患者接受CAR-T疗法后继发性恶性肿瘤。
目前,FDA已经明确表示,接受CAR-T疗法的人群中T细胞恶性肿瘤的总体发病率相当低,且尚无法完全证明是CAR-T疗法引起的。而随着人们对CAR-T疗法不断祛魅,未来也将更能正视这一疗法的益处和风险,并客观应对。
驯鹿生物相关负责人指出:“这个事件其实也给了行业一个提醒,那就是安全性问题仍旧是相关药企需要审慎对待的。并且提示我们应重视对CAR-T细胞疗法患者进行长期随访的必要性。随着随访时间的延长,以及更多临床数据的积累,不论是监管机构还是医生、患者,都会对CAR-T疗法的认识进一步加深,CAR-T的安全问题也能得到进一步的确认,这是技术进步的过程,也是行业发展的必经之路。”
1月29日,黑框警告事件不久后,FDA出台了《CAR-T细胞疗法开发考虑》最终行业指南。不过,从时间线来看,该指南是在2022年3月发布的草案基础上形成的,仅是FDA对CAR-T疗法监管的常规动作。
源津创投万津此前已指出:“FDA的目的还是加强监管,且监管审核层面上还是以临床试验的疗效、安全性、CMC核查等为核心。”
现下,行业指南出台后,国投创业钟靖亦表示,目前来看,该指南并未对CAR-T疗法开发设下逾越成本很高的实质性障碍,预计只是会多一些开发成本。
值得注意的是,同一天,FDA还发布了一份关于基因编辑疗法的行业指南。而FDA的态度在国投创业钟靖看来是颇为开明的。“FDA近些年一直支持创新,很明显的例子就是对基因编辑疗法审批上的支持。总体上,FDA对创新疗法的容忍度还是非常高,目前无需多虑。”他说。

 产业资讯
产业资讯
 E药经理人
E药经理人  2025-05-09
2025-05-09
 42
42

 产业资讯
产业资讯
 健识局
健识局  2025-05-09
2025-05-09
 41
41

 产业资讯
产业资讯
 医麦客
医麦客  2025-05-09
2025-05-09
 41
41