 产业资讯
产业资讯
 NCCGCP1962
NCCGCP1962  2024-03-15
2024-03-15
 3935
3935
2024年3月6日,“Unveiling quality of clinical trial in China: from concern to confirmation”在国际期刊Cancer Communications(IF 16.2)正式发表。本研究是2023年5月,在国家卫生健康委员会、国家药品监督管理局和业内多位专家指导下,由李宁教授牵头,国家癌症中心/医科院肿瘤医院GCP中心团队启动,黄慧瑶、侯怡如和房虹作为第一作者共同完成。

研究背景
科学有效且符合伦理是临床试验既定的国际质量要求,也是全球药物创新与研发的先决条件。中国在2003年开始发布并推进GCP的实施,自此,中国临床试验生态系统的质量体系不断发展与提高。随着质量管理理念的演进、质量管理法规的持续完善,出于对临床试验数据完整性和质量问题的严格要求,中国自2015年7月发起一项自查核查举措。自查核查举措极大地推动了中国临床试验质量的提升,意义重大,但在这个过程中也出现部分对中国临床试验质量的潜在误解—一些国际学者对中国临床试验数据的真实性、完整性表示怀疑,而一些国内同行也认为中国的临床试验标准还低于国际平均水平,且该误解一直延续至今。
本研究系统性地回顾了中国不断发展的临床试验质量保证体系,对中国、欧洲、美国和日本之间的临床试验检查制度和核查结果进行分析比较,评估中国临床试验质量现状,并指出中国临床研究面临的机遇和挑战。
研究结果
重点结论1:中国临床试验质量保证体系发生巨大变化
2003年,中国本土化的GCP管理规范正式发布,该管理规范吸收了临床试验质量保证体系的国际理念。随着临床试验的增多,中国临床研究的参与者在能力和经验方面,以及对研究质量的认识和重视程度上都有了显著提高。企业越来越多地采用现场监查、稽查等质量保证措施来确保研究数据的真实性和完整性,同时研究质量培训、交流和分享活动也逐渐增多,中国临床试验质量体系的基本框架已经建立。
2015年,“四个最严”标准全面贯彻落实,要求申办者以更为严谨的标准,回顾和重新评估待审新药试验数据的真实性、完整性和合规性,以确保符合质量管理的最新要求。随后国家药品监督管理局发布了系列文件,以全面提升中国临床试验的效率和质量。与此同时,主动的质量促进和基于风险的质量管理理念、以及质量管理体系的方法和工具开始得到普遍接受并被广泛应用,中国临床试验质量再上新的台阶。
2017年中国正式加入ICH,试验质量管理体系和标准开始全面对接国际,数百项国际临床试验指南与标准颁布,质量源于设计(QbD)和基于风险的检查在中国得以实施,试验的核查标准、要求等因地制宜,中国临床试验进入快速协调发展阶段,临床研究数量显著增加和新药上市时间差与欧美逐渐缩小。时至今日,试验质量已经嵌入到药物研发的全生命周期中,这也将对中国甚至全球的医药创新产生深远的影响。
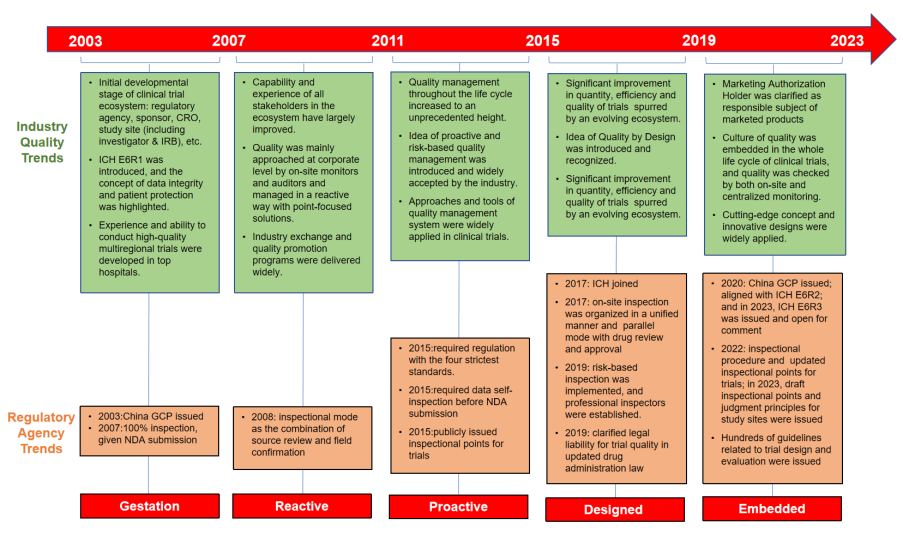
图1 近二十年中国临床试验质量体系发展趋势
重点结论2:中国已建立国际水平的临床试验质量监管框架
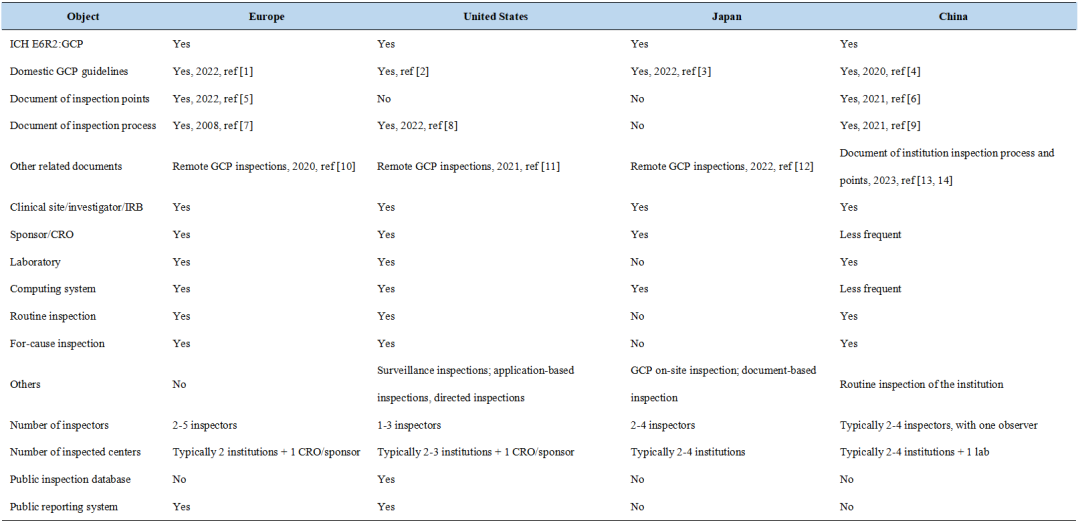
同美国、欧洲和日本类似,中国已经建立起以保护受试者权益、数据真实完整和GCP合规为核心的临床试验质量标准和质量监管框架。中国颁布并严格实施了《中华人民共和国药品管理法》、《药品注册管理办法》等一系列法律法规,同时依据“四个最严”的管理要求,推进严格的临床试验监管框架和严厉的处罚机制,以确保临床研究参研各方严格遵守GCP,保证临床试验质量。
各地区又根据自身特点,各有不同侧重。中国更倾向于对临床试验机构和实验室的审查,对申办方和CRO则根据需要实施延伸检查,还设有中国特有的机构日常监督检查,突显对临床试验机构的监管要求和力度。为公正公平,也常设有观察员观摩整个检查过程。由于注册核查结果数据库和信息化建设尚不完善等原因,日本和中国在临床试验核查结果信息公开方面还有优化提升的空间。
表1 中国与其他国家临床试验监管框架的比较
重点结论3:中国临床试验质量水平提升明显,已达到国际先进水平
2016年1月至2023年7月期间,美国FDA对欧洲、美国、日本和中国的临床试验机构共进行了2732次FDA核查。根据发现问题的严重程度,最终结果分为需要采取官方措施(OAI)、自愿采取行政措施(VAI)和不需要采取措施(NAI)三个不同的类别。分析发现,美国无需采取行动结果(NAI)比例最低,为71.3%,低于日本的98.5%(p=0.008)和欧洲的79.7%(p=0.027)。中国的NAI比例为85.0%,与其他三个地区相比并没有显著差异,显示出中国与其他被调查地区相当的试验质量。对比FDA在2016年前后对中国机构的核查结果发现,无需采取行动结果(NAI)比例由2009-2015年的48.0%提高至2016-2023年的85.0%,试验质量明显提升。

图2 中、美、日、欧四地区FDA核查结果分布
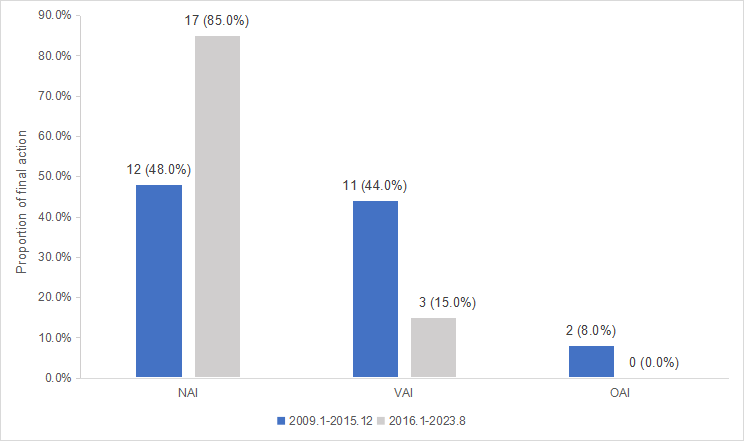
图3 2009-2015年与2016-2023年FDA核查中国临床试验结果比较
研究意义
本研究是针对我国临床试验质量的首次评估及国际比较,揭示了不论是从企业保证体系、监管核查体系还是从核查结果比较角度,中国临床试验质量过去20年取得了质的飞跃,具有中国特色、全面接轨国际并已与国际先进水平相当。研究结果可有力打消国际同行对中国临床试验质量的潜在顾虑、有助于我国加速融入全球化创新体系,提升我国在创新医药市场的国际竞争力。同时,研究也发现了中国临床试验质量可进一步提升的几个重点方向。
1.新备案试验机构研究能力和质量保证体系的完善。临床试验机构的发展仍然存在不平衡的现象,国家药监局已出台相关规定以提高新备案临床试验机构的质量体系和质量保证能力,但由于新兴机构数量快速增长,发展时间较短,研究经验有所不足。因此,新机构临床研究能力提升和质量保证体系的完善是将来的关注重点。
2.加强临床试验核查结果数据库以及相关信息化建设。持续推进临床试验,核查结果数据库信息化建设及有关信息公开,有助于行业理解并关注研究质量的常见关键问题,开展基于风险的监查,主动实施风险管理,以更高效地提升试验质量。
3.质量监管理念与核查实施的统一协调。保证质量理念与质量实施的统一协调是质量提升的关键。质量源于设计(QbD)等国际理念已在中国被全行业广泛接受,在研究核查时更多关注试验实施的关键质量方面,而不仅仅是验证单个数据的准确性,可帮助行业更有效地开展质量保证工作。
4.关注E6(R3)下新模式及新技术临床试验的质量挑战。E6(R3)修订的目的就是在促进临床试验设计和实施方面的创新的同时,推动临床试验高质量实施。新模式临床试验及新型治疗产品在临床试验设计和实施方面都与传统模式有所不同,质量实施关注的重点也有所区别。全行业更多的关注新模式新技术下新的质量挑战,及时制定并采纳现代化法规和指导文件,可更有效地实施新时代下的主动质量促进。
本研究特别感谢勃林格殷格翰副总监徐凌和张惠芳女士在研究设计、信息收集与数据解读等方面的全程参与和专业指导,同时感谢辉瑞(中国)研发公司副总监张静女士、拜耳国际研发北京中心总负责人张华女士给予的宝贵意见。
原文链接:Huang H, Hou Y, Fang H, et al. Unveiling quality of clinical trial in China: from concern to confirmation. Cancer Commun (Lond). Published online March 6, 2024. doi:10.1002/cac2.12528
撰稿:黄慧瑶、侯怡如

 产业资讯
产业资讯
 智药局
智药局  2025-12-15
2025-12-15
 86
86

 产业资讯
产业资讯
 Medaverse
Medaverse  2025-12-15
2025-12-15
 75
75

 产业资讯
产业资讯
 生物药大时代
生物药大时代  2025-12-15
2025-12-15
 67
67