 产业资讯
产业资讯
 药事纵横
药事纵横  2024-05-17
2024-05-17
 2179
2179
关键词:首个市场独占期依维莫司首批发货
2024年5月10日,中国生物制药(1177.HK)下属企业正大天晴药业集团(下称正大天晴公司)开发的肿瘤靶向药依维莫司片(商标名:晴维时)在正大天晴海州厂区顺利完成首批发货,从连云港市发往全国。这标志着该产品将正式投入临床,为肿瘤患者带来治疗新选择[1]。
依维莫司是由瑞士诺华制药原研的mTOR抑制剂,用于治疗多种癌症,全球年销售额一度超过20亿美元。正大天晴公司开发的晴维时不仅为国内首仿,而且是我国实施药品专利纠纷早期解决机制(下称药品专利链接制度)以来,首个因“首仿获批+首个挑战专利成功”获得12个月市场独占期(下称市场独占期)的产品。
本文主要分为市场独占期简介、依维莫司如何获得市场独占期以及对药企的启示三个部分。
一、市场独占期介绍
《药品专利纠纷早期解决机制实施办法(试行)》(下称《实施办法》)第十一条:“对首个挑战专利成功并首个获批上市的化学仿制药,给予市场独占期。国务院药品监督管理部门在该药品获批之日起12个月内不再批准同品种仿制药上市,共同挑战专利成功的除外。市场独占期限不超过被挑战药品的原专利权期限。市场独占期内国家药品审评机构不停止技术审评。对技术审评通过的化学仿制药注册申请,待市场独占期到期前将相关化学仿制药注册申请转入行政审批环节。挑战专利成功是指化学仿制药申请人提交四类声明,且根据其提出的宣告专利权无效请求,相关专利权被宣告无效,因而使仿制药可获批上市”。
笔者根据上述规定,将独占期概括为:
获得市场独占期=首个挑战专利成功+首个获批上市
(其中“挑战专利成功”是指:化学仿制药申请人提交四类声明+对相关专利提出无效宣告请求+相关专利被宣告无效)
二、依维莫司案如何获得市场独占期
(一)首个挑战专利成功
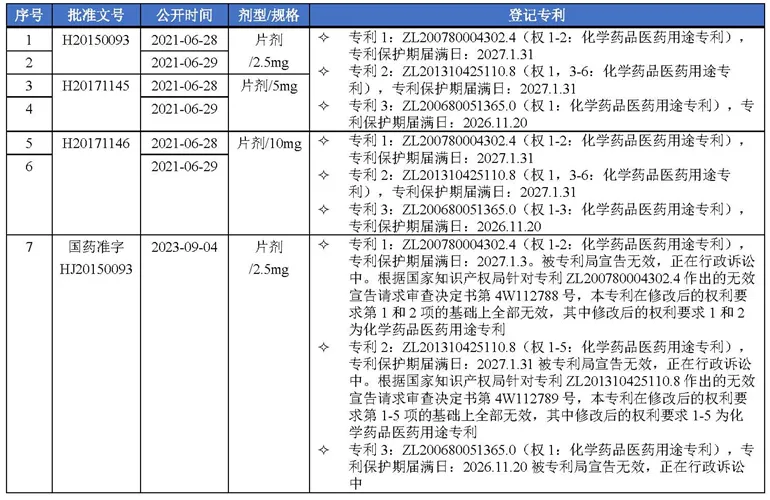
1.依维莫司原研药企专利登记情况
诺华公司针对依维莫司在中国上市药品专利信息登记平台登记了3个专利,分别为:专利1(200780004302.4)、专利2(201310425110.8)、专利3(200680051365.0),具体如表1所示[2]。
表1 依维莫司专利登记汇总表
2.依维莫司仿制药企所做声明情况
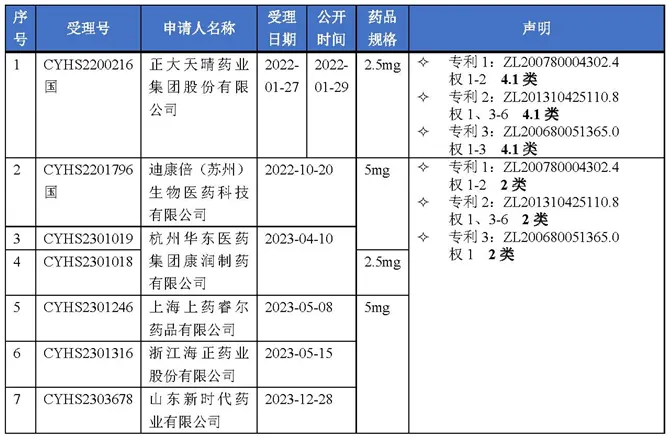
截止2024年5月13日,中国上市药品专利信息登记平台显示的依维莫司专利声明共涉及7个仿制药上市许可申请,具体如表2所示[2]。
表2 依维莫司仿制药专利声明汇总表
3.依维莫司专利挑战情况
正大天晴公司分别于2021年7月31日、2021年8月1日、2021年6月19日对专利1(200780004302.4)、专利2(201310425110.8)、专利3(200680051365.0)提起了无效宣告请求,国家知识产权局(下称国知局)于2022年2月25日针对专利3发出宣告专利权全部无效的决定,于2022年4月7日针对专利1、专利2分别发出宣告专利权全部无效的决定,如图1所示[3]。

图1 依维莫司相关专利无效决定首页(左为专利1、中为专利2、右为专利3)
(二)首个获批上市
2024年1月2日,国家药品监督管理局(下称药监局)官网显示,正大天晴研发的晴维时正式获批上市(见图2)。晴维时不仅为国内首仿,注册证书显示,其还将成为我国药品专利链接制度实施以来,以“首仿获批+首个挑战专利成功”获得12个月市场独占期的产品[4]。
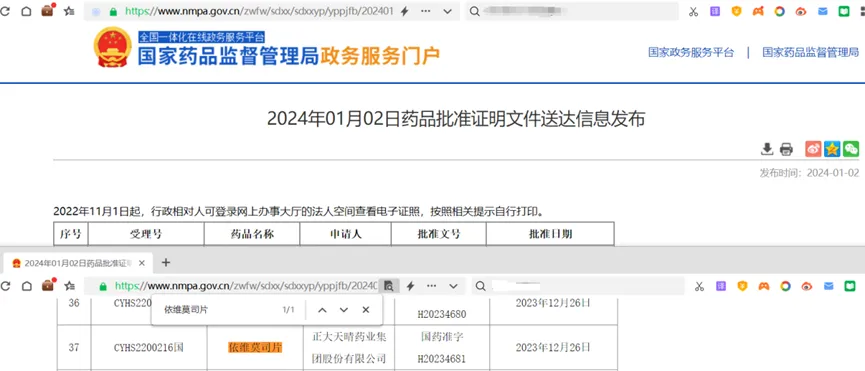
图2 正大天晴依维莫司片获批查询结果
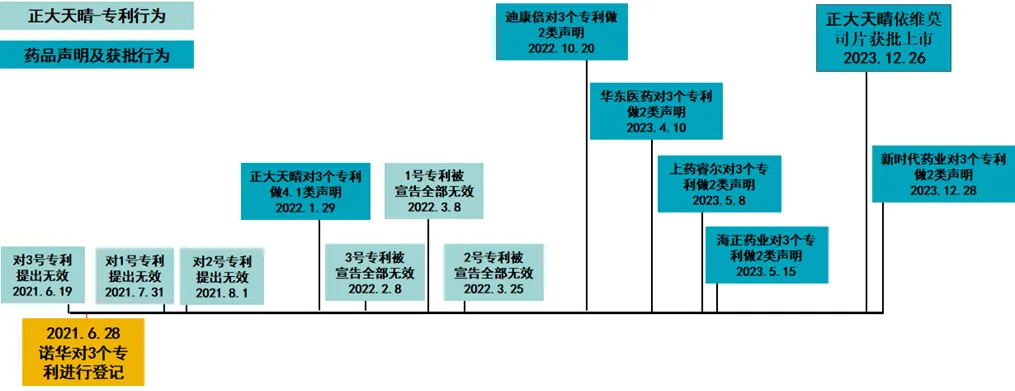
图3 依维莫司片涉及的专利登记、专利声明、专利无效以及仿制药上市时间轴
根据前述内容,笔者制作了如图3所示的时间轴,从时间轴来看,诺华公司原研的依维莫司片相关的3个专利均被正大天晴公司提起无效宣告,且均被国知局宣告全部无效;此外正大天晴公司分别针对3个专利作出了4.1类声明,由此可见,其满足了首个挑战专利成功的要件。正大天晴公司研制的依维莫司片于2023年12月26日被药监局作为首个依维莫司片仿制药批准上市,由此可见,其满足了首个获批上市的要件。
综上,正大天晴公司的晴维时满足了《实施办法》关于独占期的要求,其也意味着药监局在该药品获批之日起12个月(即2024年12月26日)内将不再批准其他的依维莫司片仿制药上市。
三、对仿制药企的启示
自2023年12月26日晴维时获批上市以来,在正大天晴公司各部门的通力合作下,晴维时终于在2024年5月10日迎来了的首批发货,留给晴维时的市场独占期还有7个月,期待在余下的7个月市场独占期中晴维时的战果,也期待正大天晴公司持续创新,不断提升产品和服务,为患者带来更多治疗选择,助力建设“健康中国”。
晴维时作为首个获得市场独占期的品种,给药企的启示如下:
首先,在药品项目调研、立项、研发、产品获批到实现投产整个过程中,药企的各个部门应当集思广益、通力合作;其次,药企应当深入了解药品专利链接制度,做好药链实务的合规管理,争取利用该制度获得市场独占期;最后,药企应当合理规划提交仿制药上市许可申请以及对原研药相关专利发起专利无效宣告挑战的时间,无效宣告的相关策略可参见《从首个拿下12个月市场独占期的依维莫司案看仿制药上市许可申请中涉及的专利无效宣告策略》。
期待药品专利链接制度可以有效推动仿制药的加快上市,提高公众对药品的可及性,希望晴维时挑战专利成功获得12个月市场独占期的案例,可以成为药企的好榜样,期待下一个获得市场独占期品种的到来!
参考资料:
[1] 网易,全国首个挑战专利成功首仿药依维莫司首批发货[EB/OL](2024.5.10)[2024.5.13]
https://www.163.com/dy/article/J1R36UBO05565EU3.html
[2] 中国上市药品专利信息登记平台,https://zldj.cde.org.cn/home
[3] 国家知识产权局专利审查信息查询系统,https://cpquery.cponline.cnipa.gov.cn/chinesepatent/index
[4] 中国证券报中证网,正大天晴依维莫司首仿获批拿下中国专利链接制度首个“独占期”[EB/OL](2024.1.2)[2024.5.13]
https://www.cs.com.cn/ssgs/gsxw/202401/t20240102_6383122.html

 产业资讯
产业资讯
 医药观澜
医药观澜  2025-12-16
2025-12-16
 41
41

 产业资讯
产业资讯
 药智网
药智网  2025-12-16
2025-12-16
 34
34

 产业资讯
产业资讯
 财经大健康
财经大健康  2025-12-16
2025-12-16
 32
32