 产业资讯
产业资讯
 识林
识林  2024-07-31
2024-07-31
 1927
1927
2024年7月26日,EMA发布了《活性物质的化学指南》(Guideline on the chemistry of active substances)草案,这是EMA在2022年发布概念文件以后,正式推出这份关键指南的草案,公开征集意见,这次征集意见在2025年1月底结束。
这份指南主要涵盖概述、介绍/背景、范围、法规基础、数据主体和参考文献共6部分。鉴于这份指南内容丰富,下面选择重点介绍。
概述
这份指南将替代《Note for guidance on chemistry of new active substances》和《Chemistry of active substances》。
介绍/背景
因为活性成分申报资料采用ICH CTD格式,因此这份指南在技术信息部分的编号都注明和ICH CTD对应的编号体系,这样可以便于读者理解这些技术信息在申报资料中的位置。
范围
这份指南主要涵盖的内容:
适用于现存/新的活性物质。其中,现存活性物质指的是已经在欧盟市场上市的制剂中使用的活性物质。
针对现存活性物质和新的活性物质,技术要求差异在各个段落进行了清晰描述。
新的活性物质定义和欧盟申报资料2A卷第一章附录1的定义保持一致。
不适用于临床阶段活性物质的信息申报。
适用于采用传统方法研发的活性物质,也适用于采用加强方法研发的活性物质。
如果企业采用加强方法开发活性物质,并开发设计空间,信息在CTD的3.2.S.2.2 到3.2.S.2.6部分提交技术信息。
提供的技术要求适用于采用ASMF或者CEP途径申报的活性物质。
法规基础
这份指南需要和Directive 2001/83/EC的附录1的(4)部分,以及Directive 2001/82/EC附录1的(2)部分结合起来阅读。
数据主体
在这部分,指南基本按照ICH CTD的S部分,依次介绍对活性物质技术信息的要求。由于内容很多,因此会选择一些重点内容来介绍。
※命名法(Nomenclature),EMA指南建议申请人提供INN名、药典名称、药典批准名称(BAN, DCF, DCIT, JAN, USAN)、
实验室编号、IUPAC、CAS。
※生产工艺和工艺控制部分
指南建议申请人应该在生产工艺部分描述替代工艺、返工工艺的技术信息。还需要在申报资料中详细描述对活性物质或者中间体质量属性影响重要的步骤。
※中间体包括分离中间体和非分离中间体;这份指南要求每种非分离中间体都应通过在括号中表示化学结构来识别。
※替代工艺
这份指南对替代工艺进行了额外细节要求:对替代工艺的解释和描述应与主要工艺的详细程度相同。工艺描述应充分定义合成方法。但是,如果提出了替代步骤或溶剂,则应提供足够的证据证明,如果通过CEP和/或ASMF提交数据,则所获得的材料(即活性物质或分离的中间体)的最终质量保持不变。
对于新的活性物质,如果遇到杂质分布的差异,应使用经过验证的方法对其进行分析,并证明它们在毒理学上是可接受的。
※返工工艺
这份指南要求更具体,细节如下:对进行常规返工的情况,应予以查明并说明其合理性。支持这一理由的任何数据都应在3.2.S.2.5中引用或提供。应清楚地描述返工方法,并应提供决定何时可以进行返工的标准。
※回收工艺
根据 ICH Q7 或欧盟 GMP 第 II 部分,溶剂、反应物、中间体或活性物质的回收(例如从母液或滤液中)被认为是可接受的。应在反应方案、工艺描述和/或流程框图中明确指出,其中回收的物料被引入工艺中。使用回收物料的影响应成为总体风险评估的一部分,并特别包括关于杂质的讨论(重点放在可能引起关注的杂质上,例如致突变杂质)。建议仅在相同的工艺中使用回收的材料,最好在同一步骤中使用,除非另有说明,否则应避免在最终制造步骤(例如化学转化/沉淀/洗涤)中使用回收物料。
※重新加工
根据目前法规要求,重新加工工艺不能涵盖在申报资料中。因为重新加工是采用一种新工艺。
※起始物料(Starting Material,SM)
对于活性物质(AS)的SM这个重点管理话题,这份指南也提供了详细介绍:
-这份指南为了厘清这个复杂话题,提供了一个流程图:
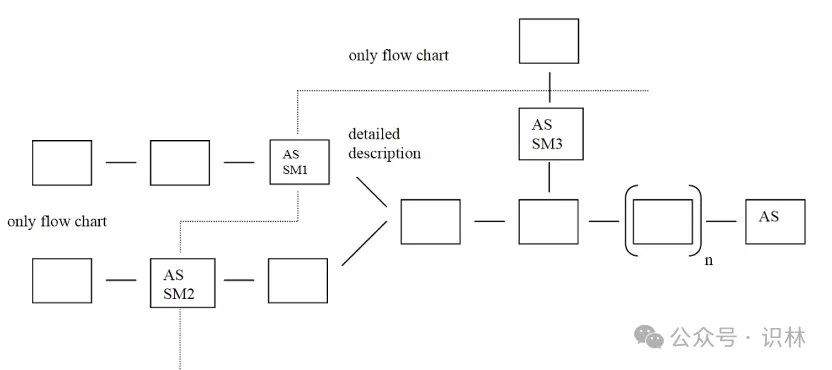
-对于亚硝胺这个热点话题对SM的影响,这份指南也提供了详细介绍:应评估起始物料合成工艺中亚硝胺的形成和残留风险(例如使用亚硝化剂、仲胺或叔胺等)。如果确定存在风险,则应建立适当的控制策略(在起始物料的标准中或在活性物质工艺的下游),或者可以探索使用不同制造工艺的其他起始物料来源。
-对于动物源或者人源的起始物料,如果在起始物料制造工艺中使用任何动物或人类来源的材料(例如由发酵、酶、氨基酸等产生),则必须提供相关的病毒安全性和/或 TSE 数据。
-对于植物来源的起始物料,根据随后的合成步骤,关于地理来源、采集或培养地点、收获和收获后处理(例如使用的熏蒸剂)的信息可能是适当的。必要时,应考虑参考欧洲药典关于草药的通论1433。
※关键步骤管理
根据这份指南,如下步骤属于关键步骤:
-多种成分的混合;
-相变和相分离步骤;
-温度和 pH 值控制至关重要的步骤;
-引入基本分子结构元素或导致重大化学转化的步骤;
-将大量杂质引入(或去除)活性物质的步骤。对于那些在活性物质中不受控制的杂质,应在合理的范围内进行适当的过程控制,并记录在案;
-最后的纯化步骤。
※工艺研发
随着QBD的理念推行,对于药品申报资料中研发信息提交要求是越来越高。这份EMA指南也体现了这一趋势。这里重点介绍对亚硝胺杂质的要求:应以EMA亚硝胺杂质问答文件为指导,努力将工艺中形成亚硝胺的风险降至最低,其中列出了风险因素,以及降低风险的措施和控制策略的原则。如果在合成工艺中不可避免地使用亚硝化剂,则应减少在适合亚硝胺形成的条件下与亚硝化化合物结合。如果形成亚硝胺的可能性是不可避免的,则应在适当的控制点实施控制策略,并根据足够的工艺知识,在必要时使用适当的分析程序来证明其合理性。
※关于结构确证方面,这份EMA指南也更新了很多近几年的技术要求。尤其对于多晶型,这份指南建议提供如下技术证据来展示是否存在多晶型:熔点(包括热台显微镜)、固态红外和近红外光谱、X射线粉末衍射、热分析程序(如差示扫描量热法 (DSC)、热重分析法 (TGA) 和差热分析法 (DTA))、 拉曼光谱、扫描电子显微镜、固体核磁共振波谱。
※分析方法验证
这份EMA指南也要求针对亚硝胺杂质检测方法验证,符合EMA亚硝胺问答的技术要求。
※活性物质的包材要求
EMA指南建议申请人涵盖如下信息:应提供储存容器密闭系统的简要说明,包括规格和适当的鉴别测试,以及建筑材料的详情。如果储存容器密闭系统对于确保活性物质的质量至关重要,则应证明其适用性。根据活性物质的性质,可能需要证明的方面包括主要包装材料的选择、避光和/或防潮、与活性物质的相容性,包括对材料的吸附和浸出和/或任何安全方面。对稳定性数据的引用可以作为额外的支持信息,以证明拟议的集装箱封闭系统的适用性。信息应涵盖整个包装,包括内包装材料(例如聚乙烯袋)和次级包装(例如纤维或金属桶)。

 产业资讯
产业资讯
 医药观澜
医药观澜  2025-12-16
2025-12-16
 37
37

 产业资讯
产业资讯
 药智网
药智网  2025-12-16
2025-12-16
 30
30

 产业资讯
产业资讯
 财经大健康
财经大健康  2025-12-16
2025-12-16
 28
28