 产业资讯
产业资讯
 医药观澜
医药观澜  2024-08-30
2024-08-30
 1095
1095
8月29日,中国国家药监局药品审评中心(CDE)官网最新公示,由中生复诺健生物申报的重组人IL12/15-PDL1B单纯疱疹I型溶瘤病毒注射液(Vero细胞)拟纳入突破性治疗品种,适应症为:经标准治疗失败的晚期肝细胞癌(HCC)。
公开资料显示,这应该是复诺健生物(Virogin Biotech)研发的新型抗肿瘤免疫增强型I型单纯疱疹溶瘤病毒在研产品VG161。今年4月披露的一项临床数据显示,既往接受过包括检查点抑制剂在内的二线治疗失败的肝细胞癌患者接受VG161单药治疗,获得了显著的临床获益。早前,该产品用于治疗晚期肝细胞癌(HCC)还曾被美国FDA纳入快速通道资格。
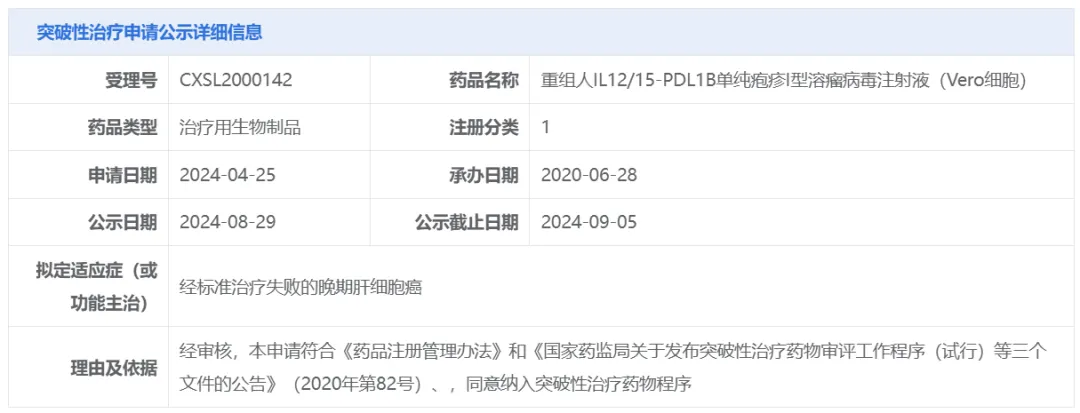
图片来源:CDE官网截图
VG161是一款新型抗肿瘤免疫增强型I型单纯疱疹溶瘤病毒,同时携带IL12、IL15/15RA(IL15和IL15受体α亚基)和PD-L1阻断肽(PDL1B)的基因。该在研溶瘤病毒产品实现了一个病毒表达4个具有协同性抗肿瘤免疫刺激作用的基因,可实现溶瘤活性与免疫刺激的协同,并能将抗病毒免疫反应转化为特异性的抗肿瘤免疫反应。
在临床前研究中,VG161显示出良好的安全性和肿瘤特异性分布,并在多个肿瘤模型中显示出显著的抗肿瘤药效,包括肝癌、软组织肉瘤和胰腺癌等。目前,VG161已完成1期临床试验,正在中美两地进行多个2期临床试验,包括单药与联合用药。
今年4月,复诺健生物宣布其一项针对晚期肝细胞肝癌的临床试验的研究成果入选2024年美国临床肿瘤学会(ASCO)年会。该研究揭示了VG161在既往接受过包括检查点抑制剂在内的二线治疗失败的肝细胞癌(HCC)患者中的临床数据。数据展示:VG161单药治疗在这些HCC患者中获得了显著的临床获益,相比对照组总生存期(OS)显著延长。
值得一提的是,2023年6月复诺健生物宣布FDA授予其溶瘤病毒产品VG161快速通道资格,用于治疗经标准治疗失败的晚期肝细胞癌。彼时FDA在回函中表示,对于经过目前可用的一线或二线治疗后进展或不耐受的不可手术切除的晚期肝细胞癌患者,VG161能够延缓肿瘤进展或改善生存期。
肝细胞癌是一种复杂难治的疾病,由于症状初期不容易被发现,约80%的肝细胞癌患者在确诊后会发展成为不可手术切除的转移性癌症。而且,绝大多数肝细胞癌患者伴有潜在肝硬化症状,需同时治疗恶性肿瘤与肝硬化。
此外,复诺健生物新闻稿还透漏,VG161已在更多癌种上表现出亮眼的临床数据。根据中国药物临床试验登记与信息公示平台信息,VG161在中国开展的多项临床研究正在进行中,适应症包括肝细胞癌、胃癌、肝内胆管癌,以及软组织肉瘤等。
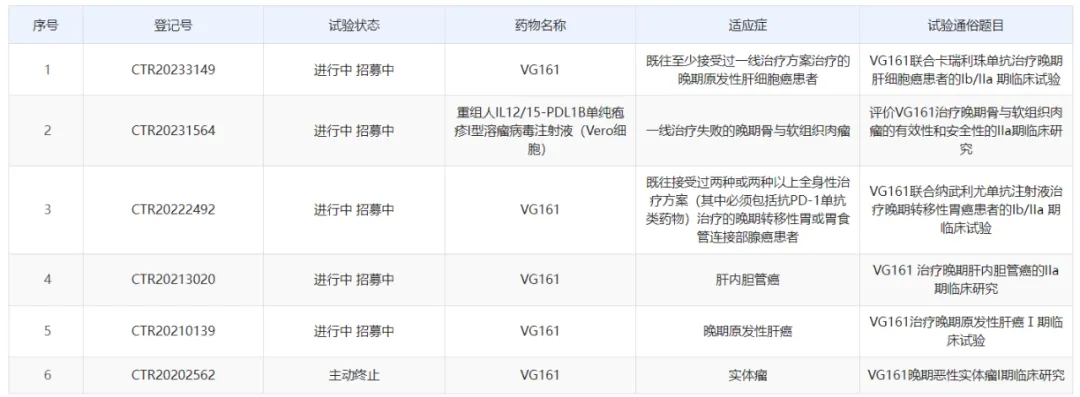
截图来源:中国药物临床试验登记与信息公示平台官网截图
期待复诺健生物的这款VG161产品后续临床开发顺利,早日为癌症患者带来新的治疗选择。
参考资料:
[1]中国国家药监局药品审评中心(CDE)官网. Retrieved Aug 29,2024, From https://www.cde.org.cn/main/xxgk/listpage/da6efd086c099b7fc949121166f0130c
[2]Virogin Biotech Oncolytic Virus VG161 Benefit in HCC Patients Featured at ASCO 2024 and Case Reports in Sarcoma Published in Oncology Letters. Retrieved Apri 15,2024, From https://virogin.com/virogin-biotech-oncolytic-virus-vg161-benefit-in-hcc-patients-featured-at-asco-2024-and-case-reports-in-sarcoma-published-in-oncology-letters/
[3]前沿资讯 丨 溶瘤病毒VG161获美国FDA授予快速通道资格FTD! Retrieved Jun 19 , 2023. From https://mp.weixin.qq.com/s/K1SUIfr1ceLnZX907qHrqA

 产业资讯
产业资讯
 医药观澜
医药观澜  2025-12-16
2025-12-16
 17
17

 产业资讯
产业资讯
 药智网
药智网  2025-12-16
2025-12-16
 17
17

 产业资讯
产业资讯
 财经大健康
财经大健康  2025-12-16
2025-12-16
 15
15