 产业资讯
产业资讯
 新药前沿
新药前沿  2024-09-30
2024-09-30
 1794
1794
今年6月全球首款PDE3/4双重抑制剂Ohtuvayre(ensifentrine)吸入用混悬液获得FDA批准,而且该项目在中国也正在进行Ⅲ期临床试验研究中,无疑让国内的follow者感到时间紧迫性。
近期,恒瑞的HRS-9821吸入混悬液和海思科的HSK39004吸入混悬液已快速推进到Ⅰ期临床试验中,加入到PDE3/4双重抑制剂竞争。
正大天晴的吸入用TQC3721混悬液是中国研发进度最快的国产PDE3/4双重抑制剂,已经完成Ⅰ期和Ⅱa期临床试验,并于9月7日至11日在奥地利维也纳举办的第34届欧洲呼吸学会国际大会(ERS International Congress 2024)以壁报形式入选。而在今年7月,吸入用TQC3721混悬液还在CDE药物临床试验登记与信息公示平台登记了第二项Ⅱ期临床试验(CTR20242692)。
此外,正大天晴还开发了TQC3721吸入粉雾剂,以提高未来临床患者用药便利性抢占更广泛市场。该项目也于9月9日获CDE临床试验默示许可。
PDE3/4抑制剂3大follow者正大天晴、恒瑞、海思科,正在对原研产品Ohtuvayre形成围攻之势。
有意思的是,ensifentrine化合物专利已过期,尽管Verona还布局多件制剂专利,如在国内:吸入液体制剂专利(CN106794157B及其分案申请CN111249260B)国内保护期到2035年,晶型专利(CN103313985B)保护期到2031年,此外,后续正在开发的ensifentrine干粉吸入制剂也申请了专利(CN114286672A实审中),如授权保护期将延至2040年。未来在国内是否会遭遇仿制药开发者专利无效挑战还有待遇观察。
Verona Pharma公司的PDE3/4双重抑制剂Ohtuvayre(ensifentrine)吸入用混悬液在今年6月获得FDA批准用于治疗慢性阻塞性肺病(COPD)之后,该公司并没有停止该项目的继续开发。
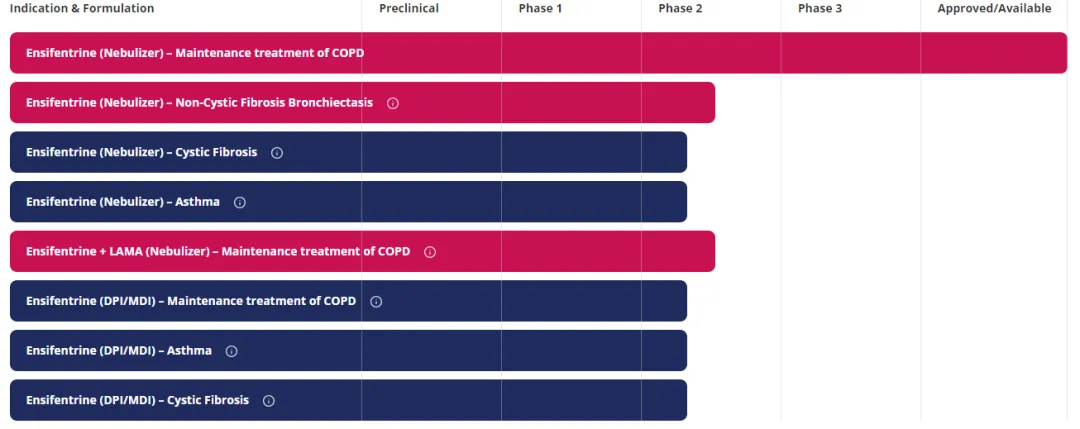
Ohtuvayre治疗非囊性纤维化支气管扩张、囊性纤维化和哮喘,以5与长效抗胆碱药物(LAMA)格隆溴铵固定剂量组合维持治疗COPD适应症的研究,都已经推进到Ⅱ期临床试验阶段。
更为重要的是,Verona Pharma开发的ensifentrine吸入粉雾剂(DPI)和定量吸入气雾剂(MDI)亦进入到Ⅱ期临床试验研究中。
尽管行业分析师认为Ohtuvayre将很快成为重磅炸弹级产品,如GlobalData预测该药到2029年销售额将达到10.5亿美元。Ohtuvayre在美国每月维持治疗费用为2950美元,年度成本为35400美元。
不过美国的临床医生对Ohtuvayre的应用却出现了分歧和质疑。
首先,Ohtuvayre每天通过雾化器给药两次,每次持续五到七分钟。用药的不便利可能会导致患者治疗依从性降低。Verona认为美国预计大约一半的COPD患者已经使用手持雾化设备,这种给药方式不会对该药物市场产生太大影响。但该公司继续开发ensifentrinedeDPI/MDI就已经很说明问题了。
其次,从临床研究看,Ohtuvayre更像是primary care,而非secondary care。Ohtuvayre的研究对象并不是病重患者,而是非标准护理人群。因此,研究中的很多患者本应接受三联疗法,但并没有,而是接受了单药治疗,并被随机分配继续接受新疗法或安慰剂治疗(在ENHANCE-1和-2研究中,三分之一的患者仅使用LAMA,16%的患者使用ICS/LABA双联吸入剂,没有患者使用三联吸入剂)。所以,把需要接受更高一级治疗的患者随机分配到新疗法Ohtuvayre与安慰剂中,取得积极的研究结果是肯定的,不过这也遭到医生质疑进行这种试验的道德性。没有将其作为已经使用三联疗法患者的附加疗法进行研究,没有将其作为正在使用LAMA/LABA且效果不佳的患者进行研究,是要添加ICS还是Ohtuvayre?因此,Ohtuvayre的临床试验是为了尽快通过监管终点线,而忽略了对临床医生来说非常重要的临床相关问题。

 产业资讯
产业资讯
 智药局
智药局  2025-12-15
2025-12-15
 104
104

 产业资讯
产业资讯
 Medaverse
Medaverse  2025-12-15
2025-12-15
 93
93

 产业资讯
产业资讯
 生物药大时代
生物药大时代  2025-12-15
2025-12-15
 81
81