 产业资讯
产业资讯
 医麦客
医麦客  2024-12-05
2024-12-05
 1327
1327
今年,全球首款TIL疗法和TCR-T细胞疗法相继获批上市,细胞治疗领域正不断取得新的突破。据统计,国内上半年共54家企业有新的申报/受理进展,涉及了57款细胞治疗药物,包括CAR-T、干细胞、TIL等超10种类型,涵盖45项新药临床试验(IND)获批记录、1项新药上市申请(NDA)批准以及1项NDA受理,多样化已成为当下细胞治疗赛道发展基调。
今年10月,清华大学、国家药监局创新药物临床研究与评价重点实验室等机构的多名研究者于《Journal of Hematology & Oncology》发表了一篇文章,文中提到在2005年1月1日至2024年8月1日期间,我国注册的细胞治疗临床试验达到2794项。全球范围内,细胞治疗领域的研究和商业化显著加速。
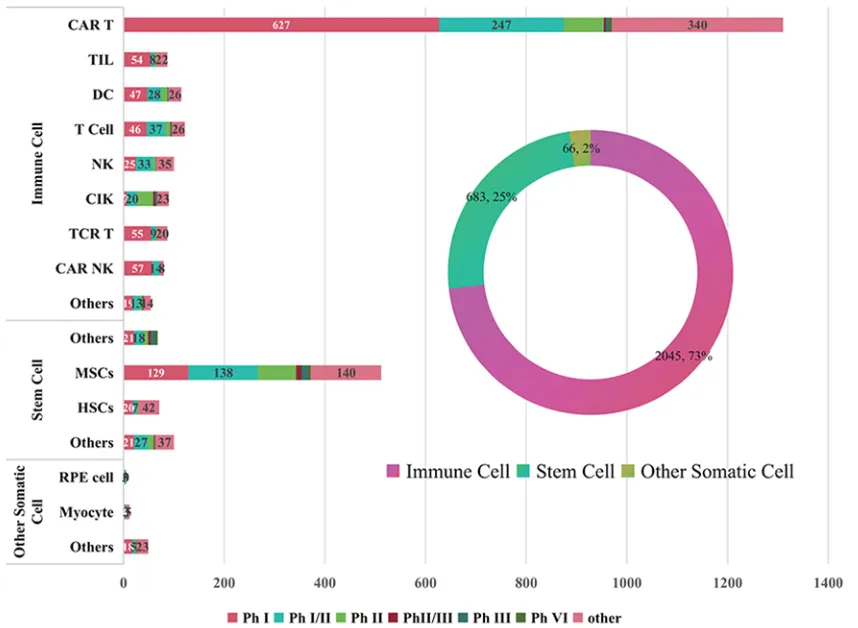
(2005-2024年中国不同阶段的细胞疗法类型,来源:参考资料1)
与此同时,美国作为支付能力最强、新药监管水平最高的国家之一,是当下国内企业实施全球化布局,避免内卷的一个“走出去”的重要目标国家,中美双报也成为了一大趋势。传奇生物的西达基奥仑赛注射液已经在中美获批上市,是首款成功出海的国产细胞治疗产品。另外,百吉生物、易慕峰、来恩生物、睿健医药、爱姆斯坦等都完成了中美IND双报双批。
多维度把控原材料,
打通药物研发全流程
无论是推动临床前研究还是管线的商业化进程,均需要以“质量过关”为前提。质量源于设计(QbD)理念强调了前置药物的质量控制,这也意味着企业从原材料(Raw Materials)的选择上就要严格把关以符合监管要求,规避后续可能存在的风险。
在原材料的选择方面,企业可以从以下几个关键要素进行考量——质量控制和安全性、合规性、产品质量稳定性。
质量控制和安全性
当细胞治疗产品处于临床前期阶段时,如果事先并未考虑到所选原材料质量是否符合IND标准以及后续药物上市申请的标准,可能会在进展到临床开发阶段遇到一系列复杂的问题,包括更换原材料、进行额外的可比性研究、需要提供更多证明资料等。而在一开始选择原材料时就重点考量其“等级”则会使从早期阶段到后期阶段的开发变得更加容易。这可以参照《中华人民共和国药典(2020年版)》(以下简称“《中国药典》”)和美国药典(USP)<1043>章节。尽管二者对原材料的具体定义上存在表述不同,但在分类范围和选择原则的大方向上是一致的。
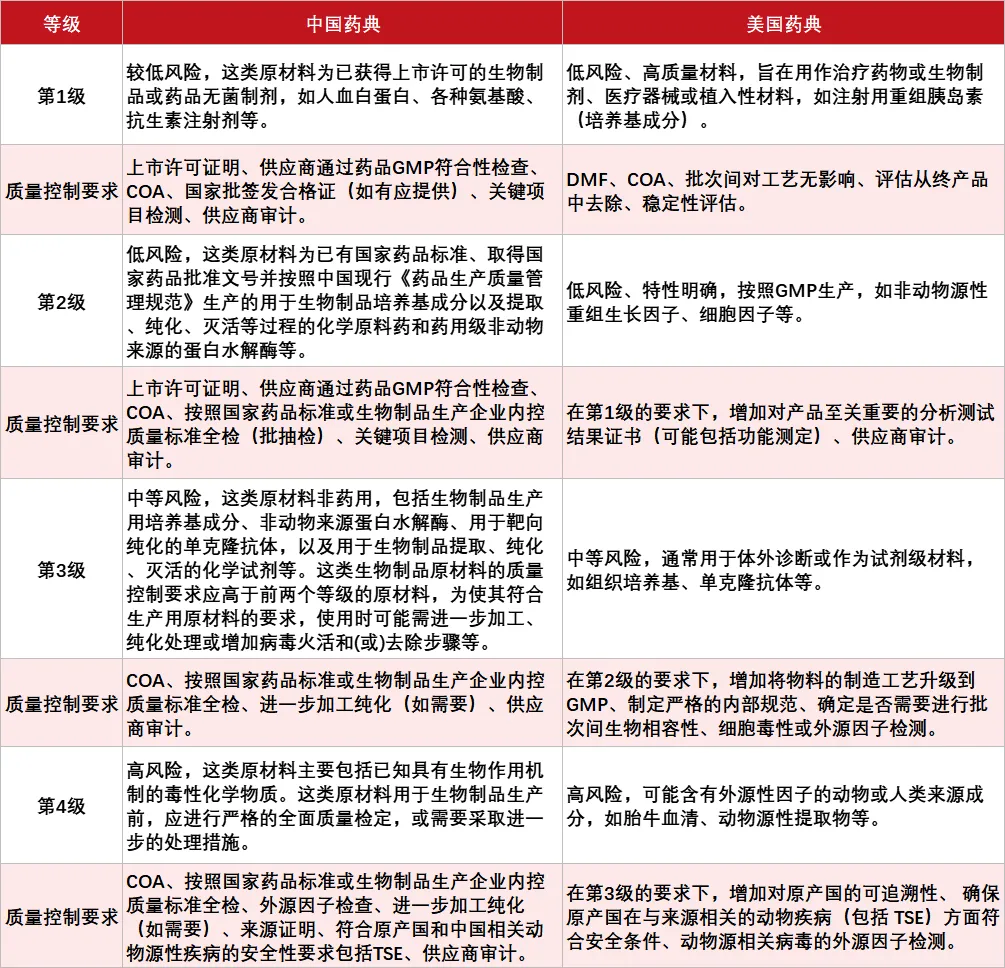
(中美药典分级管理对比,来源:医麦客制图)
可以看到,从第1级到第4级,其对应质量控制要求存在较大区别,高风险等级的原材料不仅质量控制要求更加复杂,且被建议在产品研发早期就评价使用这些原材料的必要性,并寻找其他替代物。FDA也持相同的态度,建议使用可获得且可行的最高质量的原材料。
整体而言,在同一种原材料的选择原则上,优先选择低风险级别的,如药用无菌制剂优于药用制剂、药用级优先于非药用级、GMP级优先于非GMP级、非动物源性优先于动物源性材料等。尽管高质量级别原材料可能成本较高,但从临床前到临床开发乃至提交上市整个过程来看,其带来的长期利益是显而易见的,在保障产品质量的同时能够降低不确定性和节省开发时间,在成本效益比上更具优势。另外,企业需要建立完善的质量管理体系和风险控制机制,进一步确保细胞治疗产品的安全性和有效性。
合规性
考虑到细胞治疗产品的质量以及后续申报的顺利,其原材料需要满足所在地的法律法规要求。在选择原材料时,细胞治疗企业需要评估供应商的资质,供应商应具备相关的生产许可证、GMP认证、ISO认证等,确保其具备生产高质量原材料的能力和条件。
综合中美的质量控制要求考量,企业可以从供应商处获取必要的资质文件,如出厂检验报告(COA)、药物主文件(DMF,Drug Mater File)、监管支持文件(RSF, Regulatory Supporting File)和原产地证书(COO)等是至关重要的。其中,COA是最基本的资质文件之一,包含了原材料各项质量指标的分析结果,如鉴别、纯度、微生物检测等。COO作为原材料原产地证明文件,保障了原材料的可追溯性,如果使用动物源材料,还需要TSE/BSE声明。这两个文件可以为企业进行进一步风险评估和验证提供数据。
值得一提的是,随着细胞疗法在国内审批的不断增加,国内监管机构逐渐完善原材料的质量管理规范,对原材料合规性评定和提供的文件的详尽程度提出了更加明确的要求。尤其是对于原材料中涉及到生物来源的组分和亚组分,更加强调其来源追溯和风险控制。在近期申报的很多案例中,都要求原材料生产企业提供详尽的文件说明。
另外,对于计划出海的细胞治疗产品,DMF适用于美国、日本、加拿大等地区,可用于药物IND、NDA等申请。而不支持原材料备案的国家和地区则可以参考RSF,其对于标准操作程序(SOP)的制定和质量控制(QC)至关重要,也是支持IND和NDA提交的重要文件。选择具有合格资质文件的原材料,可以为后续的申报和国际化进程奠定坚实的基础。
产品质量稳定性
终产品的质量稳定性关乎着其安全性、有效性和患者的治疗效果,要保障终产品质量的稳定性就意味着需要从源头把控——原材料质量的稳定性,这也要求细胞治疗企业建立严格的供应商审核和管理机制。
在选择原材料供应商时,一方面需要考虑到供应商对原材料的批次间稳定性的把控,是否注重原材料的生物安全性和可追溯性,以确保在生产过程中能够持续获得高质量的原材料。另一方面需要评估供应商的制造能力,其产能是否满足后续扩大规模的需求,且在扩产的过程中可以提供必要的技术支持,确保产品质量不受影响。
前置考量,无惧变更
细胞治疗赛道是螺旋式发展的,且技术更迭非常迅速,而这可能会导致企业在不同阶段出于各种原因而寻求变更。监管机构已经充分注意到企业的这种需求并出台了相关指导原则,如FDA的《Manufacturing Changes and Comparability for Human Cellular and Gene Therapy Products》和CDE的《自体CAR-T细胞治疗产品药学变更研究问题与解答》(以下简称“《CAR-T变更研究》”)。
原材料变更是常见的变更事项之一,《CAR-T变更研究》中表明,当关键原材料(例如血清、磁珠、培养基等)发生变更时,变更研究中除开展原材料本身的工艺、质量等变更可比性研究外,还需要关注原材料对CAR-T产品的影响。
原材料的变更需要开展一系列的可比性研究,一定程度上会延缓企业的进展并提升成本,因此,企业在研发初期就应高度重视原材料的选择,尽可能选择质量稳定、供应可靠、符合法规要求的原材料。并且,《CAR-T变更研究》还鼓励采用化学成分确定的原材料替代人源/动物源性原材料,或替代使用质量控制等级更高的生产用原材料,这意味着高质量等级原材料的使用是细胞治疗发展的必然趋势,满足后期最高监管要求则无需进行变更,有望加速研发进程。另外,文件中也提到,“如果涉及到原材料生产场地转移、生产工艺变更等,应提供相关支持性数据,证明变更前后原材料质量具有可比性”,这也说明了原材料质量稳定的重要性。
除了原材料外,FDA和CDE鼓励制造工艺变更朝着可扩展、自动化、封闭式发展,且越早引入这些工艺越有利于变更的顺利进行。基于对发展趋势的把握,赛默飞陆续推出了CTS DynaCellect磁性分离系统、CTS Rotea逆流离心系统、CTS Xenon电转系统等自动化封闭式仪器,能够高效应对细胞的分选、处理(分离、洗涤、浓缩等)以及电转流程,助力优化细胞治疗药物的制备工艺。
赛默飞Gibco CTS系列产品,
为顺利过渡全方位保驾护航
为助力细胞治疗企业能够从前期研究顺利扩展到临床和商业化阶段,赛默飞基于细胞治疗生产企业的产品和生产工艺特点,推出了Gibco细胞治疗系统(CTS, Cell Therapy Systems)系列产品,所有CTS系列产品均按照GMP标准生产,经过安全测试,并附有法规支持文件以帮助企业简化治疗药物开发过程,以更大限度地降低风险,并减轻质量体系管控的负担。


在质量控制和安全性方面,赛默飞秉承以终为始的思路,以CGT产品的最终质量为出发点进行产品设计,CTS系列产品不仅满足GMP生产要求,同时也符合美国及欧洲药典对于细胞治疗原材料的要求;并且在产品原材料筛选的过程中进行严格的把控和溯源,对关键原材料及终产品均进行广泛的测试已确保其符合质量要求。
在合规性方面,赛默飞为CTS系列产品提供可追溯性文件和法规支持类文件,同时成立了具有区域专业知识的细胞基因治疗法规事务团队来提供全方位支持。目前赛默飞CTS系列产品已被应用在全球200多条临床管线中,国内外已经商业化的细胞治疗药物中也大多使用了不同类别的CTS产品。
在稳定性方面,赛默飞通过严格的供应商筛选和生产过程监控以确保产品的质量稳定性,同时通过多产地生产、供应协议、定制化生产等战略响应市场变化,应对不确定性,保障产品的稳定可靠。
“做一步看十步”的前瞻性思维,以及从源头端把控产品质量的实践,不仅是对当前市场环境的精准把握,更是对未来发展趋势的深刻洞察,这将会更好助力企业未来在细胞治疗市场的竞争中占据有利地位,引领行业谱写新篇,再创佳绩。
参考文献:
1.Du X, Luo X, Liu L, Cao Y, Zhang Y, Zhang Y. Mapping the cell therapy landscape: insights into clinical trials and regulatory advances in China. J Hematol Oncol. 2024;17(1):96. Published 2024 Oct 14. doi:10.1186/s13045-024-01616-8
2.《CAR-T细胞治疗产品质量控制检测研究及非临床研究考虑要点》
3.《中华人民共和国药典(2020年版)》
4.《美国药典》
5.IPRP Reflection Paper General Considerations for Raw Materials Used in the Manufacture of Human Cell and Gene Therapy Products.https://admin.iprp.global/sites/default/files/2023-03/IPRP_CTWG-GTWG_RawMaterialsReflectionPaper_2023_0215.pdf
6.《自体CAR-T细胞治疗产品药学变更研究的问题与解答》

 产业资讯
产业资讯
 医药财经
医药财经  2025-12-24
2025-12-24
 16
16

 产业资讯
产业资讯
 氨基观察
氨基观察  2025-12-24
2025-12-24
 16
16

 产业资讯
产业资讯
 思宇MedTech
思宇MedTech  2025-12-24
2025-12-24
 16
16