 产业资讯
产业资讯
 Insight数据库
Insight数据库  2024-12-11
2024-12-11
 1817
1817
12 月 10 日,NMPA 官网显示,瓴路药业/ADC Therapeutics 研发的替朗妥昔单抗(Loncastuximab tesirine)获批上市,适应症为单药治疗复发/难治性弥漫性大 B 细胞淋巴瘤(R/R DLBCL)。值得一提的是,这是国内首个获批的靶向 CD19 的 ADC 药物。


图片来源:NMPA 官网替朗妥昔单抗通过可裂解的二肽连接子将毒素 SG3199(PDB 二聚体)与抗体连接,DAR 值约为 2.3。当与表达 CD19 的肿瘤细胞结合时,会被细胞内化,随后释放 PDB 二聚体细胞毒素。PBD 与 DNA 小沟结合,形成强效的细胞毒性 DNA 链间交联,导致 DNA 复制停滞,阻断细胞周期从而导致肿瘤细胞死亡。
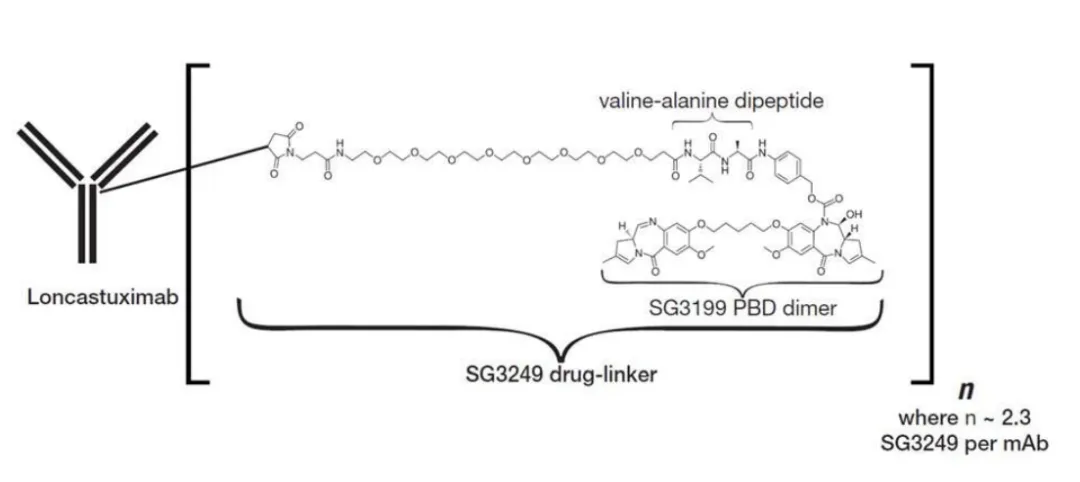
图片来源:药品说明书
2021 年 4 月 23 日,替朗妥昔单抗获 FDA 加速批准,用于单药治疗此前至少接受过 2 线及以上系统性治疗的 R/R DLBCL 成人患者,成为目前首个也是唯一一个靶向 CD19 的 ADC 药物。2022 年 12 月,替朗妥昔单抗也获得 EMA 的附条件批准。
FDA 批准是基于 LOTIS-2 (NCT03589469) 研究,这是一项开放标签、单臂 II 期临床研究,纳入 145 名复发或难治性 DLBCL 或高级别 B 细胞淋巴瘤成年患者,这些患者既往接受的中位系统治疗的线数为 3 种,包括对一线治疗耐药的患者、对既往所有治疗均无效的患者、具有双/三打击的患者,以及造血干细胞移植和 CAR-T 治疗后复发的患者,主要终点指标是 ORR。
结果显示,145 例患者中有 70 例完全或部分缓解,ORR 为 48.3% ,CR 为 24.1%。中位随访时间为 7.3 个月,中位缓解持续时间(DOR)为 10.3 个月 (95% CI: 6.9, NE)。

图片来源:Insight 数据库
此次在国内申报上市是基于中国桥接 II 期注册临床试验 OL-ADCT-402-001,评估替朗妥昔单抗单药用于治疗复发/难治性弥漫大 B 细胞淋巴瘤(R/R DLBCL)中国患者的有效性和安全性。
今年 9 月公布的最新数据显示,64 名患者接受了替朗妥昔单抗单药治疗,患者的ORR 为 51.6%,CR 为 23.4%,而且耐受性良好。试验数据与该药针对白人患者的全球研究数据一致(LOTIS-2)。
据 Insight 数据库显示,替朗妥昔单抗还有一项包括中国在内的国际多中心的 III 期临床试验正在开展,与利妥昔单抗联用二线治疗 R/R DLBCL(LOTIS-5),Insight 数据库预计可能在 2028 年完成。
目前,CD19 靶向的 ADC 药物布局者并不多,处于活跃状态的仅四款,其中两款为靶向 CD19/CD22 的双抗 ADC 药物,均处于临床前阶段;其余还有一款 CD19 靶向的 ADC 进入 I 期临床。
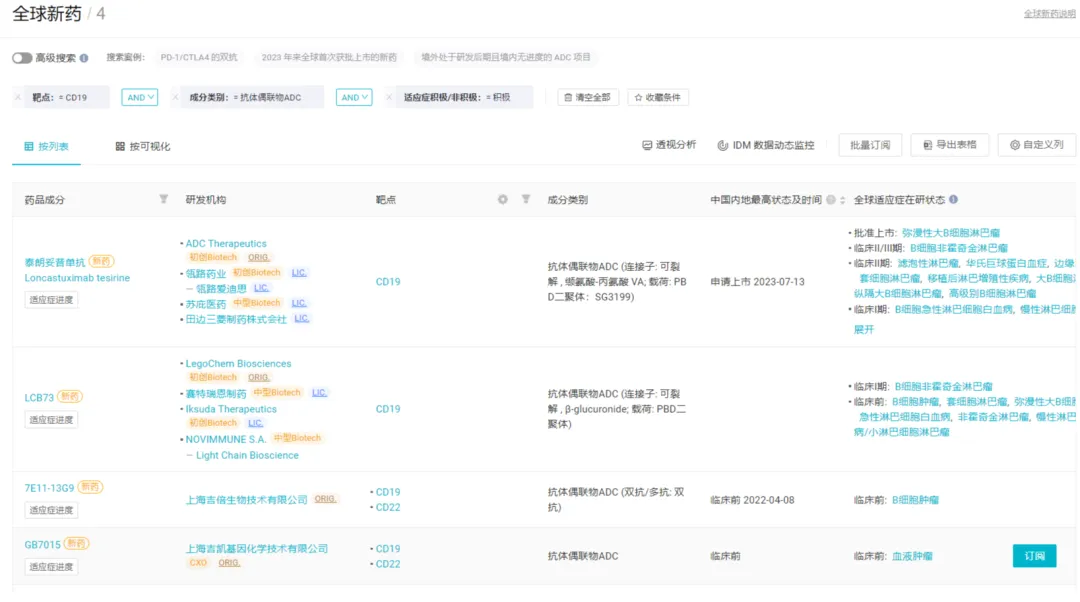
图片来源:Insight 数据库

 产业资讯
产业资讯
 医药观澜
医药观澜  2025-12-16
2025-12-16
 29
29

 产业资讯
产业资讯
 药智网
药智网  2025-12-16
2025-12-16
 23
23

 产业资讯
产业资讯
 财经大健康
财经大健康  2025-12-16
2025-12-16
 21
21