 产业资讯
产业资讯
 同写意
同写意  2024-12-21
2024-12-21
 675
675
经历漫长的努力后,Mesoblast终于将Ryoncil推向美国市场。
12月18日,根据公告,FDA已批准Ryoncil(Remestemcel-L)作为美国首个间充质基质细胞(MSC)疗法,针对2个月及以上儿童患者的类固醇难治性急性移植物抗宿主病(SR-aGVHD)。
Ryoncil基于同种异体骨髓生成,通过抑制T细胞增殖,下调促炎细胞因子和干扰素的产生,从而调节T细胞介导的炎症反应。
各种标签叠加,令Mesoblast在取得监管突破后,当日股价大涨54.04%,重回四年前水平。
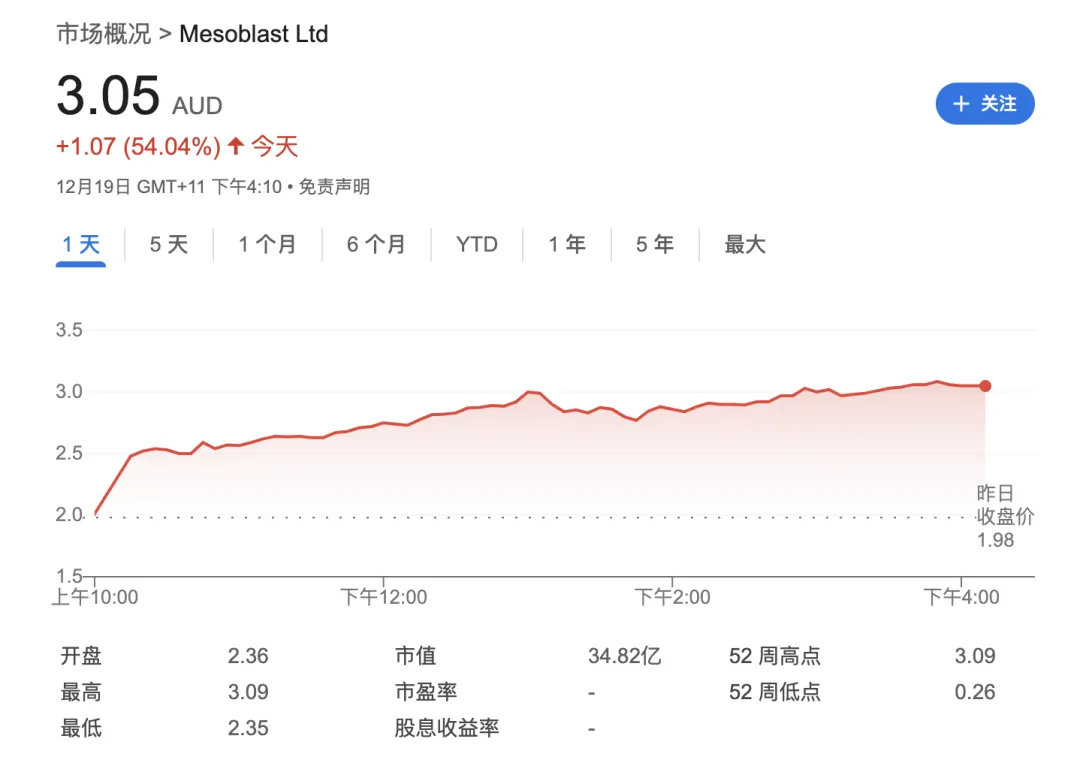
1
首款疗法
虽然Mesoblast已经成立20年,并一直专注开发同种异体(所谓的“现货型”)干细胞疗法,但Ryoncil却并非完全出自其收笔,而要追溯到另一家公司Osiris Therapeutics身上。
1992年,Osiris开始研究骨髓MSC的应用——公司的名称,正来源于埃及神话中的冥王奥西里斯(Osiris),象征着干细胞对生命的重要价值。随后,Osiris推出了由健康青年捐献者骨髓MSC制备而成的Prochymal。
FDA曾在2010年5月,以孤儿药方式核准Prochymal用于I型糖尿病的治疗,但Prochymal的真正商业化从2012年开始。
彼时,Prochymal在加拿大和新西兰成功上市,用于GVHD儿童患者,成为全球首个获批的异体骨髓MSC疗法。次年,Mesoblast从Osiris收购Prochymal,并将其更名为Remestemcel-L,由此开启了新的市场开发。
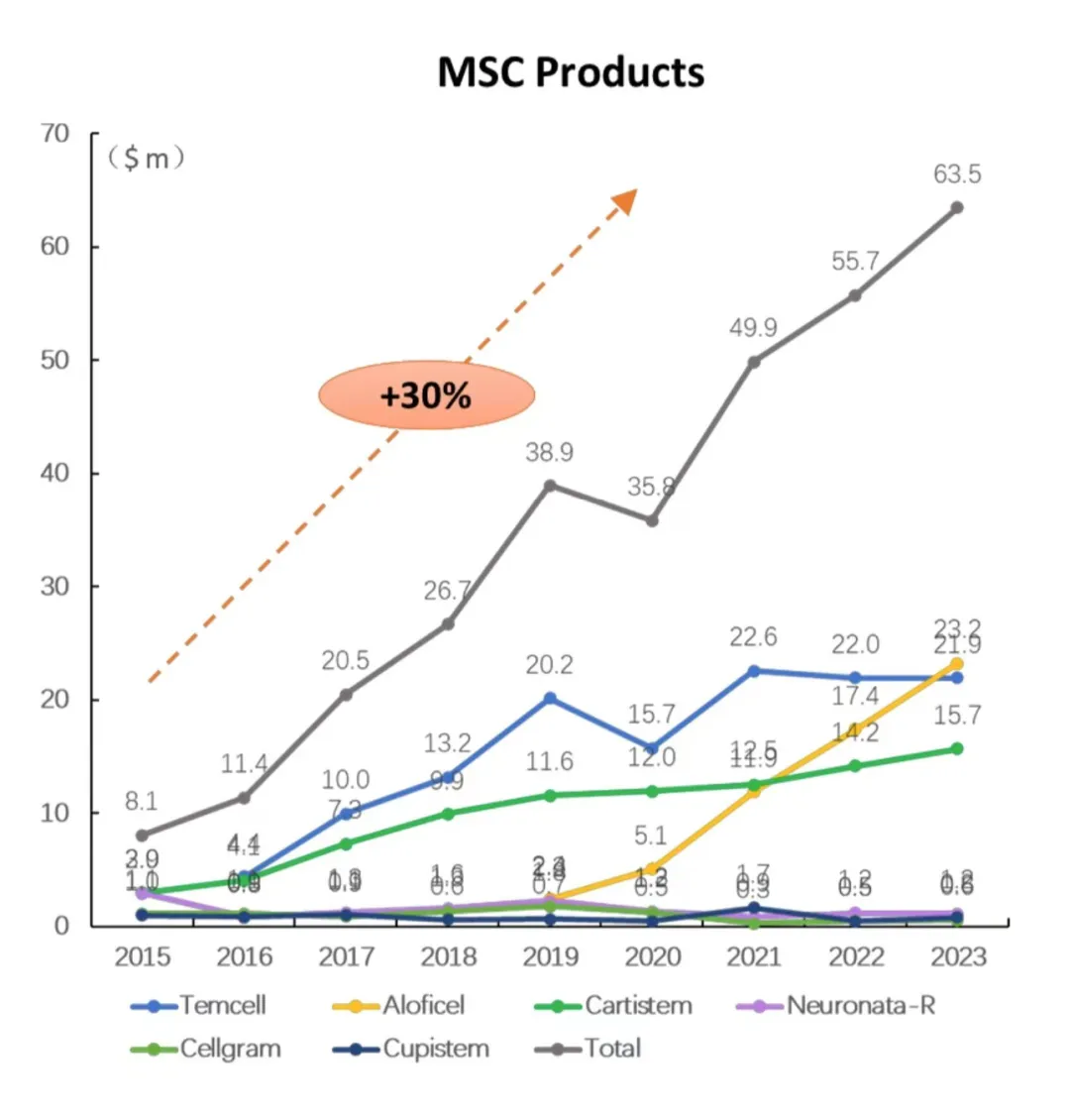
在Mesoblast手上,Remestemcel-L于2016年2月登陆日本,商品名为Temcell,Mesoblast合作伙伴JCR Pharmaceutics负责销售。
根据日本政府国民健康保险规定,Temcell每袋报销额约合7700美元,而普通成年患者预计至少接受16袋或最多24袋治疗,基于此,Mesoblast曾预计,日本成年患者接受Temcell治疗的报销额在12.3万美元到18.5万美元之间。
然而,Remestemcel-L进军日本市场的成绩似乎并不非常理想。例如在2023初披露的财报中,Mesoblast称,其获得的特许权使用费收入为190万美元,按照固定汇率,也比上一年度的230万美元少了20万美元。
截至2024年6月30日,过去一年来自Temcell的特许权使用费收入为550万美元,同比减少了160万美元,仅有40万美元是由于日元对美元贬值造成的汇率变动。
不过,中源协和CSO、同写意CGT俱乐部理事长张宇认为,这并不能直接说明Temcell有什么实质问题。
“跟美国市场相比,日本市场还是比较小的,所以具体判断它最后的销售潜力,要看在美国上市以后的定价以及后续表现。”张宇补充说。
2
几经周折
的确,无数案例表明,高定价的美国才更像“奶与蜜之地”。但Remestemcel-L赴美之路同样不好走。
2019年5月,Mesoblast首次向FDA提出上市申请,当时的临床资料显示,Remestemcel-L治疗反应率和患者存活率都很高。2020年8月,Mesoblast还获得FDA肿瘤药物咨询委员会的背书,后者以9:1的投票结果赞成批准该药。
然而,2020年10月,FDA却出人意料地拒绝了该申请,并要求至少再进行一次随机对照研究,以便为Remestemcel-L的疗效提供更多证据。
到了2023年3月,Mesoblast再度提交BLA ,数据中纳入至少4年的长期存活结果,以及高危患者的疗效资料。此前,FDA还完成对Mesoblast生产设施的许可前检查,并无任何问题。
可5个月后,2023年8月,FDA仍向Mesoblast发出CRL。在信中,FDA并未提出任何安全性问题,却认为在重新考虑该药物的申请前,该公司应提供更多成年患者的资料。随后,Mesoblast股价暴跌。
Mesoblast首席执行官Silviu Itescu回忆称,收到FDA的CRL次月,他们派人前往沟通,向FDA专家重新展示了Remestemcel-L的各项数据和产品的科学原理。今年1月,Mesoblast跟FDA联系,希望得知还有哪些研究需要补齐,此时FDA的答复是,资料已经足够。
最终,在12月,Remestemcel-L以Ryoncil的商品名获得批准,用于治疗SR-aGVHD。
业界的一个期待是,Ryoncil提供了替代类固醇疗法的选择——GVHD通常需要高剂量类固醇治疗,但对类固醇治疗无反应的患者预后不佳——并且填补针对12岁以下患有GVHD的儿童疗法的空白。
Mesoblast指出,美国每年约有1万名患者接受同种异体造血干细胞移植(allo-HSCT),其中包括约1500名儿童。约有50%的患者会出现GVHD,其中近一半对类固醇没有反应。
相比之下,54名接受allo-HSCT后患有SR-aGVHD的儿童患者参与的Ryoncil研究显示,16名参与者(30%)在接受Ryoncil治疗28天后达到完全缓解,而22名参与者(41%)达到部分缓解。
3
一鼓作气
“随着Ryoncil获得FDA批准,Mesoblast已证明有能力将首款MSC产品推向市场。”Itescu对外表示。根据FDA的批准,Ryoncil将在美国移植中心和医院上市。
9月,Mesoblast曾对外透露,Ryoncil的库存已经准备完毕,并且“已建立供应链,以确保冷冻保存的产品在获得批准后可立即交付,满足每个站点的需求,并有能力在未来根据需要扩大规模”。
Mesoblast聘请了有经验的专业人士,开展针对性的商业战略,“因为50%的儿科移植手术仅在15家中心进行”。所以,Ryoncil的分发将首先面向那些经验最丰富、用量最多的中心,“然后再分阶段推出”。
目前,Ryoncil的美国定价暂未放出。但无论是Mesoblast,抑或其他细胞疗法市场玩家,都对此次获批抱有更多希望。
“Ryoncil是有划时代意义的。从既往FDA批准的细胞疗法看,无论是CAR-T、TCR-T还是TIL,主要还是集中自体产品。”张宇评价说,“FDA的批准代表了一个趋势,未来市场上,同种异体的细胞疗法可能会越来越多。”

“我们将继续与FDA密切合作,以获得我们其他后期产品的批准,包括用于心血管疾病的Revascor和用于炎症疼痛适应症的Remestemcel-L,以及扩大Ryoncil在患有炎症的儿童和成人中的适应症。”Mesoblast在公告中写道。
Revascor(Rexlemestrocel-L)同样是一款“现货型”细胞疗法,近期对外发表的III期临床结果显示,使用Revascor可提高缺血性心力衰竭(HF)和炎症高风险患者的生存率,并降低主要发病率。
2018年7月,Mesoblast还与国内的天士力达成合作,在中国开发、生产和商业化Revascor(用于治疗慢性HF)和MPC-25-IC(用于治疗急性心肌梗死)。天士力认购了前者2000万美元的普通股。
从机制上看,T细胞是免疫系统的一部分,由骨髓中的干细胞发育而成。Ryoncil这类MSC疗法的免疫调节作用(包括抑制T细胞活化和促炎细胞因子分泌),使得它们有可能用于治疗过度炎症疾病的其他适应症。
大量数据表明,MSC疗法具备不错的安全性,张宇相信,加上“现货型”的设计,可以令普遍高昂的细胞疗法随着适应症扩大而进一步降低成本。
而Ryoncil,某种程度上就是这场考验的第一位交卷考生。成绩如何,且看来日。
参考资料:(上下滑动查看更多)1.FDA Approves First Mesenchymal Stromal Cell Therapy to Treat Steroid-refractory Acute Graft-versus-host Disease
2.Mesoblast’s RYONCIL® is the First U.S. FDA-Approved Mesenchymal Stromal Cell (MSC) Therapy
3.Mesoblast has received FDA approval for its drug Ryoncil
4.Breakthrough FDA approval for Ryoncil to treat children sends Mesoblast shares soaring by 46pc
5.First Allogeneic Cell Therapy Product Launched in Japan by Mesoblast Licensee
6.Mesoblast Reports Operational and Financial Highlights for Quarter Ended December 31, 2022
7.干细胞治疗:研究进展与产业现状——兼评全球首个胚胎干细胞药物
8.《同種異體》FDA 再次拒絕批准 Mesoblast 的移植物抗宿主疾病 (GvHD) 細胞療法 remestemcel-L (Ryoncil) ,公司股價暴跌66%市值約35億台幣

 产业资讯
产业资讯
 药融圈
药融圈  2025-07-07
2025-07-07
 29
29

 产业资讯
产业资讯
 医药魔方Pro
医药魔方Pro  2025-07-07
2025-07-07
 32
32

 产业资讯
产业资讯
 药研网
药研网  2025-07-07
2025-07-07
 34
34