 产业资讯
产业资讯
 识林
识林  2025-01-04
2025-01-04
 1440
1440
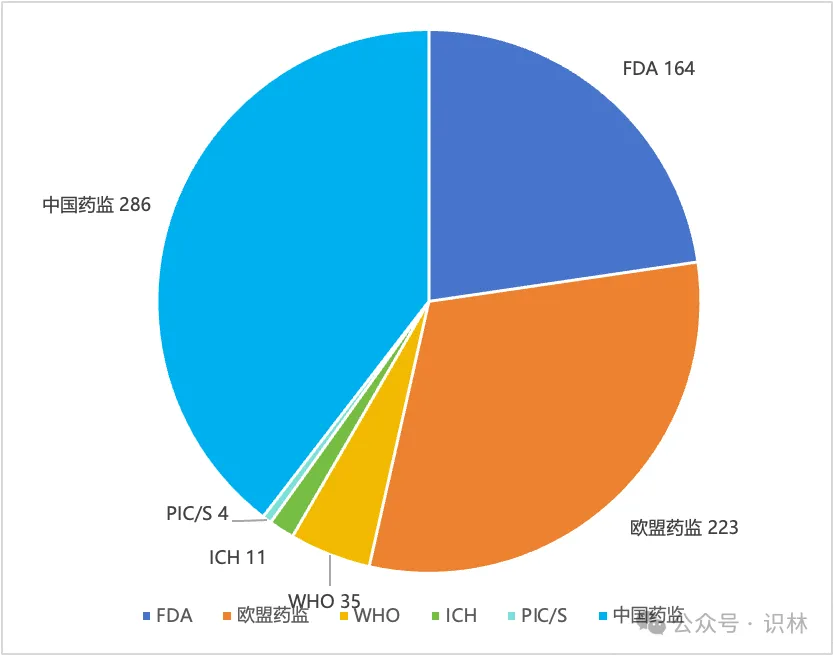
2024年,识林更新了全球主要监管机构的数千份官方文件。剔除各类公告通知、个药标准或BE、年度报告等内容,仅保留与企业日常工作最相关的法规指南内容, 6大主要监管机构发布了723篇法规指南类文件。其中,中国286篇(包含非药监部门发布的重要文件),欧盟药监223篇,美国FDA 164篇,ICH 11篇,PIC/S 4篇,以及WHO 35篇。
本文将对上述文件做分类,并基于分类和发布时间,为大家做简单的导读。能力和篇幅所限,不求全面而精深,只为与业界同仁一起回顾刚刚过去的2024年药品监管领域的重点与亮点,展望今年的各项工作。无论业界如何风云变幻,药品生命周期全过程的合规将永远是承载着人民群众生命健康的制药业的根本所在。
基于数字的概览
可以看到,中国药监体系保持着与2023年一样的势头,继续倾力构建坚实的药品监管法规体系,在发文数量上处于领先。FDA的数量相比2023年有所下降,而欧盟升至第二。WHO和ICH与2023年持平,PIC/S则在2023年大量更新GMP指南的基础上,仅更新了4篇指南文件。
国际组织虽然发布量较低,但影响面却可能相当广。PIC/S的4篇文件分别针对“加入程序和标准”和“远程评估”,前者是正走在申请路上的NMPA必须关注的,而后者可能引导全球药品检查逐步尝试更多的“远程检查”,从而充分利用日新月异的互联网技术,在确保检查效果的同时降低成本。这也是企业所乐见的。
与2023年主题分布于生命周期各阶段不同,ICH的11篇中大多数与临床试验有关,包括M12相互作用,M14真实世界数据,M15模型引导药物研发等等。WHO依然更加关注低收入地区的疾病和药物,但药用辅料GMP、亚硝胺和QC实验室规范等指南也引起了国内业界广泛关注。
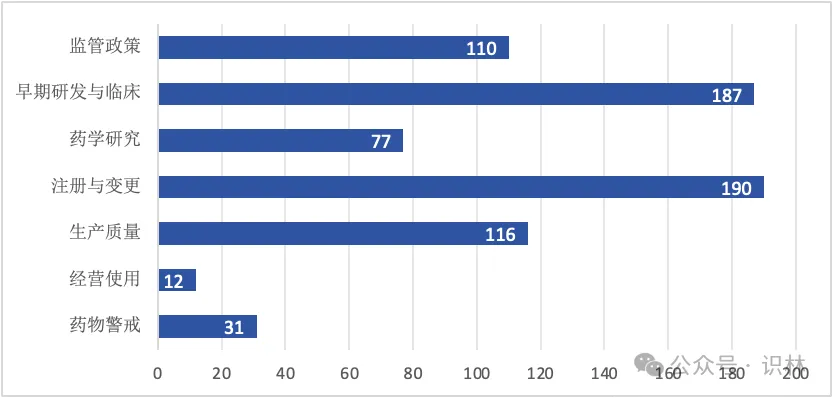
从分类数量来看,一如既往,临床和注册领先,经营和药物警戒较少,药学研究与生产质量居中。
中国药监与FDA
将目光聚焦到中、美两个药监体系,先从发布数量看。
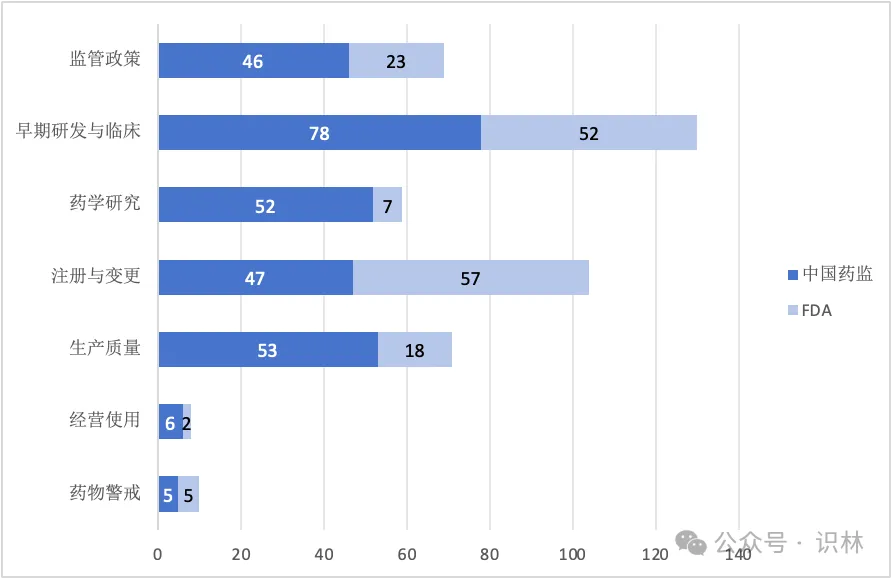
与各有侧重的国际组织不同,中美监管机构需要对所辖范围内大量公民的用药健康负责,因此发布的文件涵盖整个药品生命周期,但在细节上也能看出差异。这尤其反映在中国药监在大多数分类的发布数量上均领先FDA。对比2023年概览中的数据,我国曾经在“早期研发与临床”领域落后,如今也实现了数量上的反超。当然,数量不能等同于质量和影响力(此外由于监管体系差异,统计口径也存在差异),但这些数字在一定程度上体现出我国在药物研发创新的道路上的探索和进步,也将成为接下来监管与业界共同努力向前的基础。
再从关键词看。
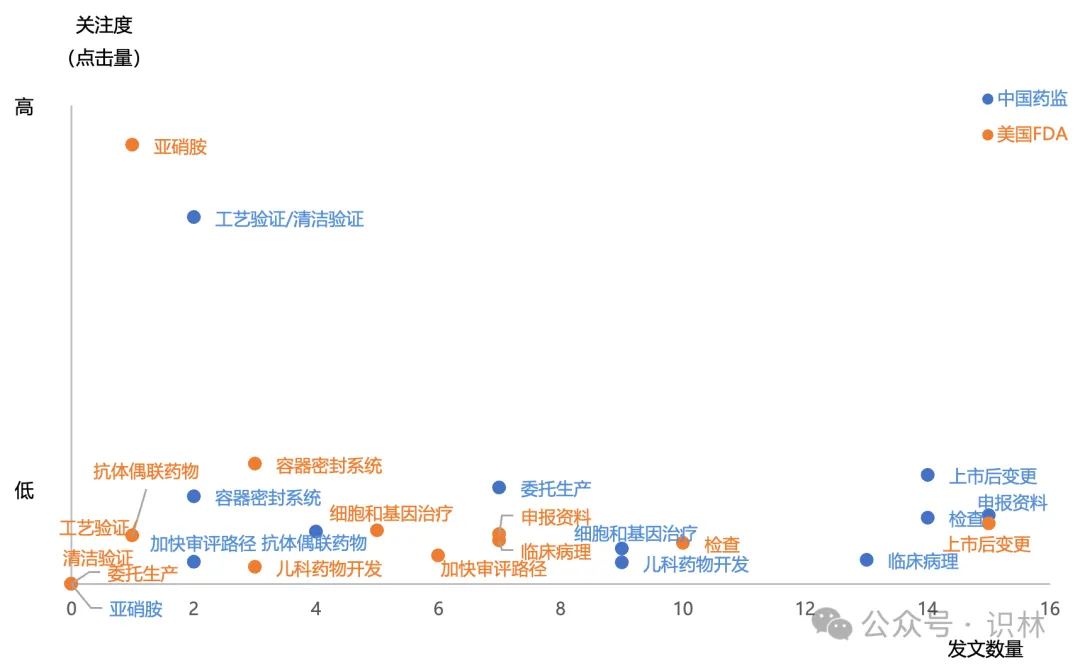
这些关键词,是从识林用户点击量最高的2024年发布文件中提取的,体现的是监管发文与业界关注点的契合。从这个角度看,相比2023年的关键词(1
持有人和委托生产;2 检查;3 亚硝胺;4 加快审评;5 上市后变更;6 儿童药;7 污染;8 说明书;9 真实世界;10 先进疗法;11 沟通交流;12
放射性药品;13 药品短缺;14 以患者为中心),大同小异。
看一些处于极端位置的关键词。
从点击量上看,FDA的“亚硝胺”,仅发一文《人用药中亚硝胺杂质的控制》但点击量很高,而国内2024年并未针对其发文。查阅识林主题词【亚硝胺】可知,国内指南还是2020年的《化学药物中亚硝胺类杂质研究技术指导原则(试行)》。与之相对的是国内的“工艺验证/清洁验证”,CFDI在2024年发布的两篇指南,针对生产质量体系的两个棘手问题,且填补了国家级指南的空白。而FDA未发相关文件。
从发布数量上看,FDA发了相当多与“上市后变更”有关的文件,其中《MAPP 5018.3 ICH Q12 中所述既定条件的实施》尤其值得我国企业和监管关注,因为Q12即将在我国实施(根据NMPA适用公告 ,2025年8月25日时两年过渡期截止),但从业界反馈看,尚未发挥这个指南对于变更的促进作用。国内药监发了较多指导“申报资料”编写的文件,其中的境外地产化、生物制品分段申报等文件都旨在切实推进相关政策的实施。
基于分类,中外对比,回顾每月重点发布
下面按照监管政策、早期研发与临床、药学研究、注册与变更、生产质量和经营使用与药物警戒主题,将每个类别的重点文件概要回顾。
不同企业和岗位,对“重点”的理解自然不同。本文中是基于对文件影响力的理解以及识林用户的点击数据做综合判断,概述也不会涉及其中每一篇文件,仅供大家回顾参考。
药监年度重点发布概览:监管政策
监管政策领域的文件,大多看似与药企日常工作关系不大,但往往具有相当的前瞻性,可能对业界带来深远的影响。
2024年最受业界关注的,莫过于11月的《NMPA 关于加强药品受托生产监督管理工作的公告(征求意见稿)》,其内容大家早已耳熟能详。监管趋严是肯定的,但趋严的前提是监管要求本就存在,并非无端地“从无到有”,将之解读为“开倒车”或是“取消B证C证”则绝非务实的态度。与其怨天尤人,不如花时间仔细审视自己的质量体系,从部门设置、人员资质、文件体系这些最直观的开始,是否有按基本要求在开展工作。一方面是趋紧,另一方面,与委托生产十分相关的政策是生物制品分段,在生物制品逐渐成为创新主流的时代迈出了“松绑”的重要一步。
6月NMPA的《药品监管人工智能典型应用场景清单》是目前全球主要监管机构发布的第一篇针对监管场景AI应用的文件,也昭示了未来药监部门拥抱AI技术的路径。如果药监用上了AI大幅提效,而企业还在靠人工去处理海量的信息和数据,此消彼长,合规压力可想而知。国外在AI方面最为积极的是欧盟,不仅EU率先发布了全球第一份人工智能法案,EMA也在9月连发两份指导性文件。FDA承诺2024年发布的AI指南至今还未面世,不过FDA在11月召集新成立的数据健康专家委员会连开两天会讨论如何监管生成式AI。
国内的另一个重点是经营和准入的合规,尤其是10月《医药企业防范商业贿赂风险合规指引(征求意见稿)》和11月《医药代表管理办法(征求意见稿)》,体现了国家医疗、医保、医药的“三医联动”政策思路。其发布背景是医保国谈、集中带量采购、重大腐败案件等,在业界引发广泛讨论。
近几年常常挂在欧美药监局长们嘴边的“药品短缺”,不仅多次发文,平时还在多个场合不断呼吁,可见在药品监管较为成熟、市场化程度也更高的欧美,由市场规律所导致的短缺已经成为公众特别关心的大问题,直接影响患者用药可及性。
PIC/S在年底更新《关于加入药品检查合作计划(PIC/S)的指南》提醒我们NMPA已经处于加入进程当中,药企可以期待未来检查互认带来的诸多好处,但也不能忽视这些好处是建立在更加良好的质量管理体系之上的。
表1. 中外药监年度重点发布概览:监管政策

药监年度重点发布概览:早期研发与临床
该分类主要包含与临床试验相关的文件,但也有非临床研究以及更早期的药物发现和成药性评估的内容。无论是数量、新技术含量、还是关注度,这个领域一直以来就是药监发文的重中之重。我国制药业自审评审批制度改革以来迈入药品创新时代,其中一个典型特征就是这类文件发布越来越频繁。
2024年,整个业界研发均需关注的是ICH的发布,包括M12,M14,M15,E6和E11,涵盖药物相互作用,真实世界数据与证据,模型引导药物开发,GCP实践以及儿科外推,中美欧也在第一时间纷纷跟进适用,影响大量在研药物临床试验。
临床合规和检查方面,除了上述ICH发布的GCP附录,FDA发布了多份与BIMO有关的指南文件。如果日常留心的话,会发现BIMO相关的警告信也为数不少。国内CFDI也在11月份连续发布多篇与临床试验(包括生物等效性)数据、记录、分析实验室的文件,并及时放出了E6附件2的中文版。
从临床指南涉及到的品种、适应症、新技术,可以看到监管对当前热点品种技术关注是否及时,也可看到促进新兴领域发展的前瞻思维。我国CDE对罕见病、基因治疗、细胞治疗(包括干细胞)、ADC以及特别有针对性的司美格鲁肽发文,FDA则在年初就定稿了两篇涵盖整个生命周期(当然重点还是临床)的CAR-T和基因治疗产品指南。此外,中美均发布了阿尔茨海默和ADC的相关指南。
国内还有改良型新药和中药的多篇临床指南。近年来业界目光大多聚焦在1类创新药,多个靶点和适应症上存在不同程度的同质化竞争趋势,而改良型新药的前提就是要有创新性的临床价值,一样属于创新范畴。指南也是在促进此类药物的研发申报。国内特有的中药新药,在“三结合”临床评价方法提出后,也需要具体指南来引导企业传承创新。
表2. 中外药监年度重点发布概览:早期研发与临床

药监年度重点发布概览:药学研究
药学研究的指南体系已经相当成熟,业界在开展工艺、质量标准和分析方法研究时,已经习惯于采用ICH的指南。监管机构发文侧重于具体品种和个别主题。本文还纳入了代表性较强的药典更新。FDA多次以MAPP(用于FDA CDER内部员工使用的政策程序手册)的形式发布药学研究内容,同样具有指南的价值。
亚硝胺仍然是焦点。相比EMA相关指南的具体详尽,8月FDA的《人用药中亚硝胺杂质的控制》并无太多关键更新,但毕竟代表了FDA最新且最全面的考量,是药企出海必读。从点击量上看,发布以来一直备受关注。
CDE针对热门靶点且开发难度较大的品种发指南,包括腺相关病毒基因治疗,ADC,GLP-1,一方面是促进研发水平提升进而加快上市进程,另一方面也说明这类品种的申报数量逐渐增多,使得监管部门从实际审评经验中得到了普遍适用的认知。
2025年版中国药典发布在即(官方对外给出的时间是今年3月份出版,10月份实施),2024年更新了大量的通则、总论和指导原则,有些是二次乃至三次征求意见,也能为药学研究、尤其是质量研究提供比较全面的参考。
表3. 中外药监年度重点发布概览:药学研究

药监年度重点发布概览:注册与变更
由于工作流程类似,尽管变更的文件通常也包含药学内容,本文还是将其与注册放在一起。
近年来的注册类文件,无论中外,主旋律之一都是“加快”。2024年,我国药监在这方面尤为积极,压缩创新药临床试验审批时限,将补充申请审评前置工作下放给部分省市局进行试点,BE备案也从30天减至15天。不仅于此,优先审评还作为一种路径激励促进境外生产药品的地产化。与之对应,FDA尽管在12月的《关于严重病症的加快审评计划 - 药品和生物制品的加速批准》中进一步阐述加快审评审批的细节,但相当篇幅在阐明上市后验证性临床和撤市机制,毕竟在许多药物获得加快上市的同时,拖延验证性临床、乃至明明无效却长期不能撤市的例子比比皆是。这种情况也值得我国业界参考。
另一大主旋律就是“上市后变更”了。这是个令业界和监管都感到棘手的主题,前者当然希望加快,后者资源也有限,希望在合理控制风险的前提下减轻审评压力。上面已提到我国已试点由省局开展补充申请审评前置工作。但其实还有个关键工具,即ICH Q12,尚未被充分利用起来。FDA在10月发布的《MAPP 5018.3 ICH Q12 中所述既定条件的实施》,是目前对于如何实施Q12最为详尽的一份文件,许多思路和方法值得企业和监管共同参考。
FDA向企业收费从而向企业以及国会做出承诺,通常在每5年更新的“使用者付费法案”(包括PDUFA,GDUFA等)中提出注册流程方面的新政策和新要求,在此期间,会以MAPP和SOPP(CBER的内部标准操作程序)的形式澄清诸多注册审评细节,而FDA内部如何审评,也就对应了企业应该如何注册。例如3月的《MAPP 6702.1 风险评估与减轻策略(REMS)评估报告的审评》和《MAPP 5016.1 将 ICH Q8(R2)、Q9 和 Q10 原理应用于化学、生产和控制审评》,同样值得注册人员深入研读,以终为始编写注册资料,与审评人员进行卓有成效的交流。
表4. 药监年度重点发布概览:注册与变更
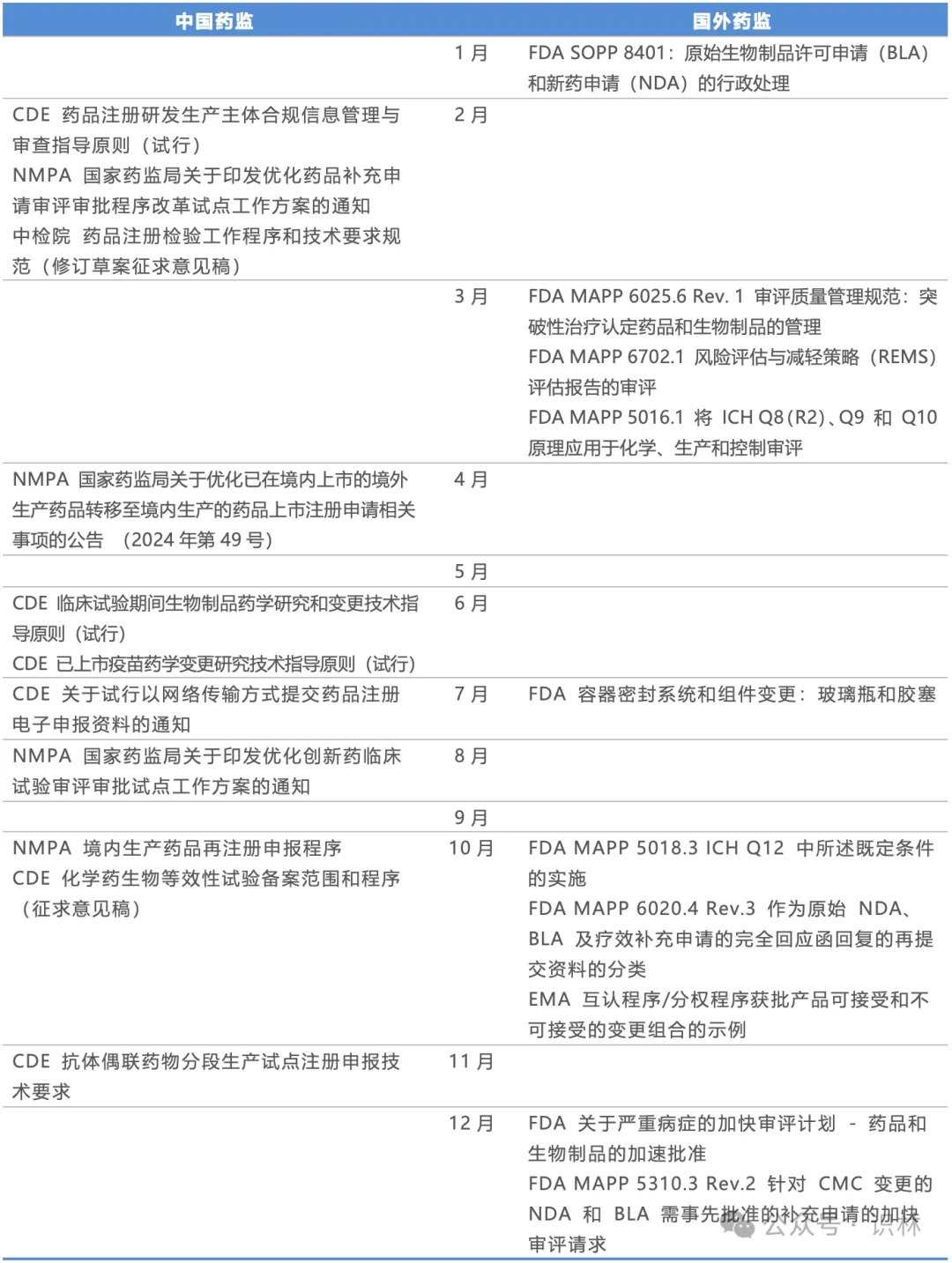
药监年度重点发布概览:生产质量
本分类涵盖广泛,包含生产质量、质量管理、质量控制,以及检查。
上文提到受托生产监管和生物制品分段广受关注,“能不能做”的问题总是特别牵动人心,但国内药监也发布了大量“怎么做”的质量管理指导性文件,包括工艺验证、清洁验证、细胞治疗和放射性药物的检查、分段检查指南(配合生物制品分段检查的新政策)、辅料和包材的GMP等等。无论A证B证还是C证,能够切实保障药品质量、且经得起检查的质量管理体系总是基本功。
说到检查,1月FDA更新了《MAPP 5014.1 Rev.1 了解 CDER 基于风险的场地选择模型》,阐述了FDA内部规划检查资源的机制,同类的还有8月的EMA的《基于风险的药品生产商检查计划的范例》。基于风险的检查,是资源有限的监管部门的共识,但到底如何评估风险,国内外、国内各省之间的做法不尽相同。我国在国家层面并未给出特别具体的“风险算法”,倒是各省局会发布一些相当直观的分级分类。不过,从这些文件来看,企业在不在某个“豁免检查的表”上,并不是可以“算”的,而是在日复一日保持良好质量管理水平的基础上“挣”来的。
ICH刚发布的《ICH ICH Q9(R1) 附件1:关于Q8、Q9和Q10的问与答(R5)》更新了25个问题,探讨了过程验证和持续改进、QbD以及实时放行测试等热点议题,也在年末再次提醒大家保持学习与实践ICH质量体系指南。
表5. 药监年度重点发布概览:生产质量
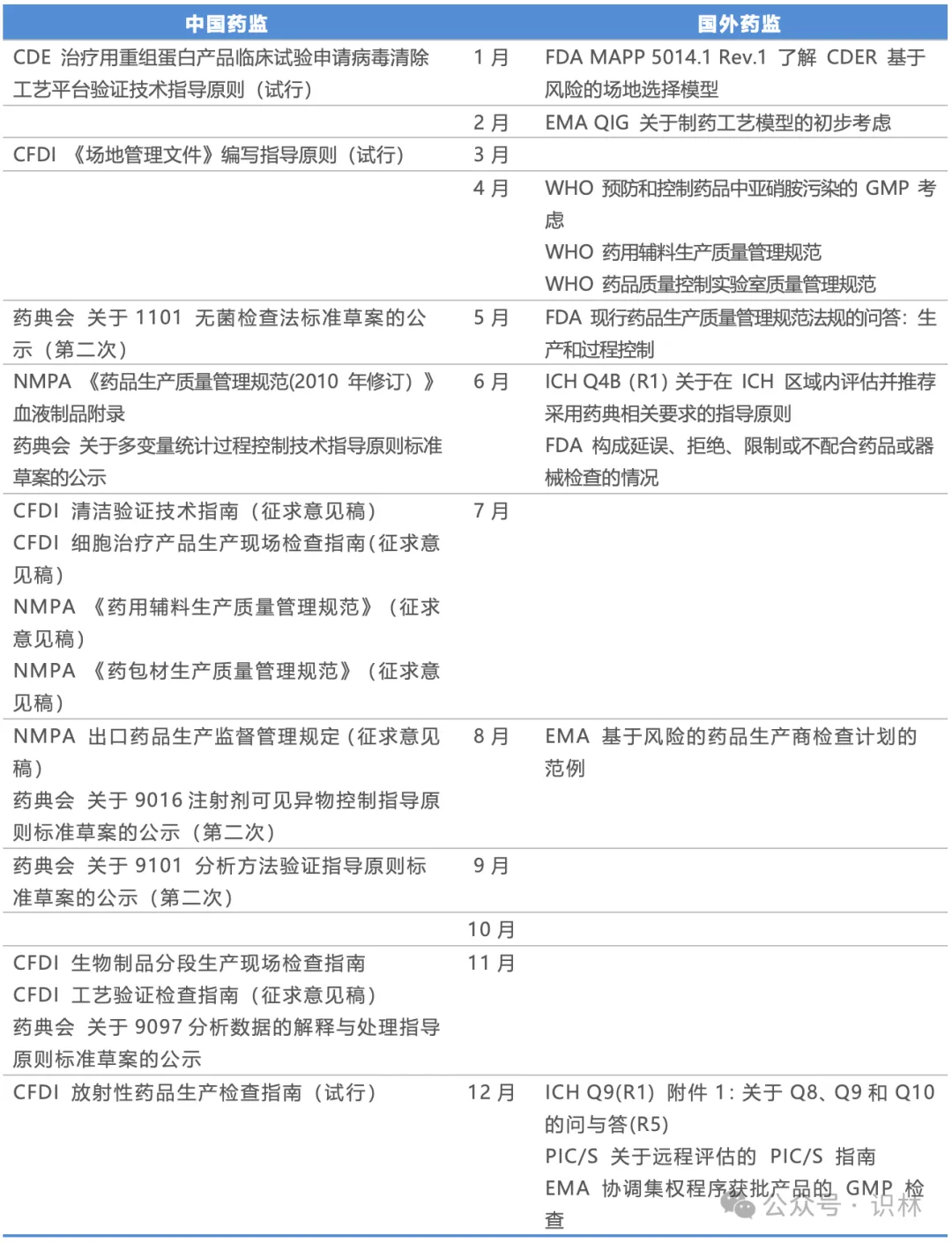
药监年度重点发布概览:经营使用与药物警戒
从数量上,经营使用和药物警戒难与上面几个类别相比。由于两者主要针对上市后监管,因此放在一起。
纵观识林数据库,欧盟发布了最多的GSP/GDP和PV相关的文件,但欧盟并非药企出海的最主要目的地,所以受关注程度不高。FDA并无GSP/GDP的提法,其提及GVP的文件还是早在2005年一篇GVP指南,但FDA的相关要求并不会少,而是分散在大量的法规指南文件当中。国产创新药纷纷在美国上市,今后只会越来越多,上市后的合规也逐渐成为重点。
除了年初国家局的政策性文件之外,国内的CDR(药品评价中心)在2024年发布了多份重要指南,涵盖安全性评价、沟通、以及基于真实数据的主动监测。
表6. 药监年度重点发布概览:经营使用与药物警戒

以上图表和简要分析,并非严谨学术研究,仅从识林视角,为大家回顾2024制药业法规指南全景提供一个参考。2025年,识林将一如既往关注来自更多机构,涵盖更完整主题的法规指南。
监管机构和研究机构在法规指南方面的努力,既是对行业的规范和引导,也源自产业的需求和激励。这种激励,体现在业界对法规指南的关注和尊重,并能基于科学和风险运用法规指南。业界有此务实心态,识林和更多志同道合的业务机构和专家所开展的各类法规指南研究工作,才更有价值。

 产业资讯
产业资讯
 医麦创新药
医麦创新药  2025-08-04
2025-08-04
 67
67

 产业资讯
产业资讯
 药时空
药时空  2025-08-04
2025-08-04
 67
67

 产业资讯
产业资讯
 Medaverse
Medaverse  2025-08-04
2025-08-04
 62
62