 政策法规
政策法规
 中国医药创新促进会
中国医药创新促进会  2025-03-01
2025-03-01
 3968
3968
罕见病防治作为全球公共卫生领域的重要议题,不仅是医疗公平问题,也是社会治理问题。党中央、国务院高度重视罕见病患者的诊疗保障需求。2024年政府工作报告明确提出,要强化罕见病研究、诊疗服务和用药保障,为罕见病患者群体提供更有力的支持。国务院办公厅发布的《深化医药卫生体制改革2024年重点工作任务》进一步强调,要加快罕见病治疗药品的审评审批,推动相关药物尽快上市,满足患者需求。
本文试对2024年罕见病药品获批与准入情况进行梳理分析,了解我国在治疗罕见病治疗药品在“有药可用”方面取得的成就,并对现存的问题进行初步探讨。
一
监管机构与产业双向发力,持续加强罕见病用药保障
2024年获批的罕见病药物数量仍在高位,彰显了我国在不断优化制度建设和扩充罕见病目录等方面所取得的显著成效。经公开资料整理,2024年我国罕见病领域共批准上市药品44种(其中有17种药品通过优先审评审批程序获批上市),与2023年获批数量基本持平,生物制品与化学药品均衡分布,分别占比48%(21种)与52%(23种)。这些药品共覆盖34种罕见病,其中14种疾病属于《第一批罕见病目录》,20种疾病属于《第二批罕见病目录》。获批的药品中,29个品种首次在我国申请上市,14个品种新增罕见病适应症,另有1个产品进行了剂型改良。从药品来源看,进口药占比64%(28种),国产仿制药/创新药占比36%(16种),与2018年首批目录公布后我国上市的30个罕见病新药均为进口药物相比,国产药物占比显著提升,国产替代提速明显。
表1 2024年通过优先审评审批程序批准的罕见病药品
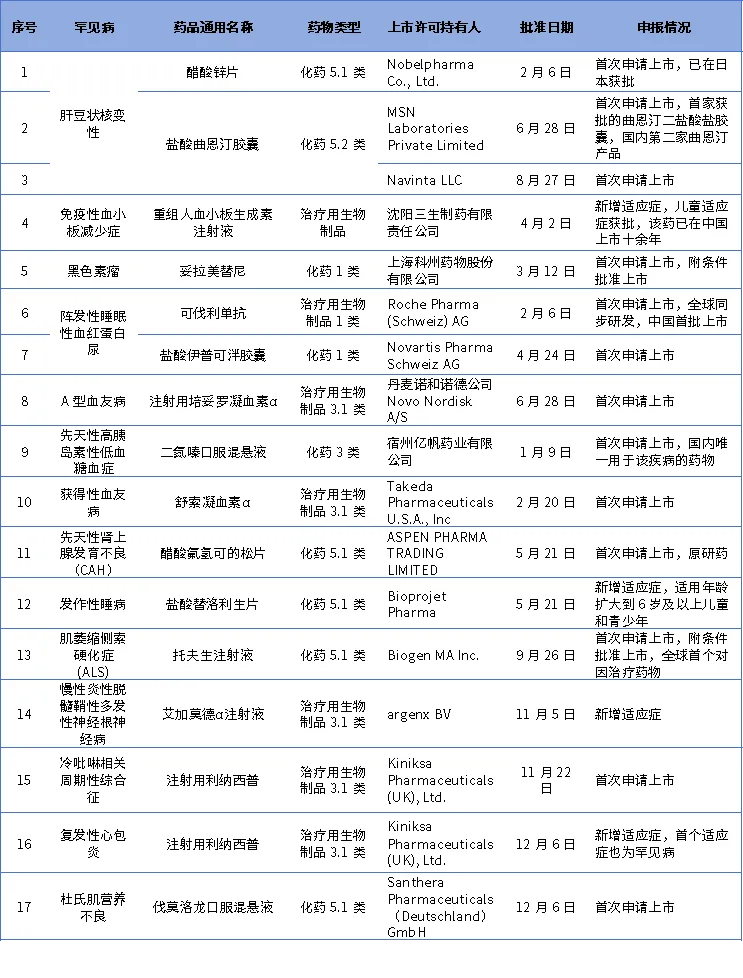
医保覆盖范围持续扩大。截至目前,已有90余种罕见病用药被纳入国家医保目录。2024年,国家医保药品目录新增了13种罕见病用药,其中包括当年获批的氯苯唑酸葡胺软胶囊、罗普司亭N01、盐酸伊普可泮胶囊等。这些新增药品的纳入,有助于进一步提升罕见病患者的用药保障水平,减轻患者的经济负担。
二
政策引擎,支持罕见病药物研发与准入
近一年来,国家和地方通过制度创新和资源优化,推动药物研发,提升患者可及性、可获得性。
2025年1月,国务院办公厅发布《关于全面深化药品医疗器械监管改革促进医药产业高质量发展的意见》,明确提出给予符合条件的罕见病用药品市场独占期、豁免临床试验、注册检验批次由3批减为1批、每批次用量由全项检验的用量的3倍减为2倍,以及探索先行进口临床急需的罕见病药品等举措,为罕见病行业带来了新的希望。
在罕见病领域,由于罕见疾病的复杂性和患者群体的特殊性,国家监管机构贯彻“以患者为中心”的管理理念,支持罕见病的药物研发。
一是引用数字技术支持临床试验去中心化,提高临床试验开展灵活性。2024年5月,国家药监局药品审评中心(CDE)发布了《在罕见疾病药物临床研发中应用去中心化临床试验的技术指导原则》,采用去中心化临床试验(DCT)模式,利用数字健康技术(DHT)支持受试者远程招募、电子知情同意、远程访视与评估、医患互动、安全性监测等。这种模式不仅能够应对罕见病药物临床试验中的患者人数少且分布分散、试验周期长、临床方案复杂、经济负担高、儿童患者多、治疗窗口窄以及上市后需持续收集患者数据等问题,还能够契合患者在真实世界的诊疗情况。
二是强化多方合作与交流,注重罕见疾病患者需求。2024年9月,CDE发布《以患者为中心的罕见疾病药物研发试点工作计划(“关爱计划”)》,将药物研发划分为研发立项、Pre-IND、关键研究前、Pre-NDA/NDA和上市后5个阶段,指导申请人在药物研发全过程引入患者的观点,提升患者体验在药物临床获益-风险评价中的科学性、规范性及合理性,并在整个过程中强化监管机构、企业与患者之间的沟通和协作,推动罕见病药物的加速上市。截至目前,已有8个药物纳入该计划。
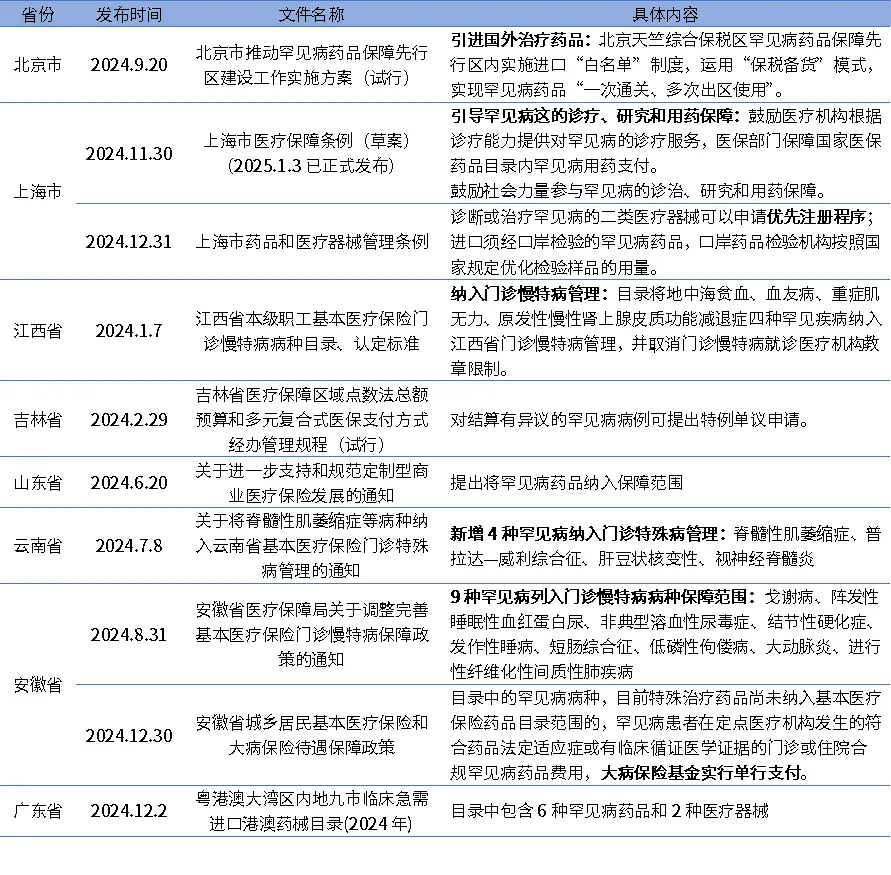
地方监管机构先行先试,积极探索满足罕见病患者用药需求。北京于2024年9月出台《北京市推动罕见病药品保障先行区建设工作实施方案(试行)》。该方案以天竺罕见病药品综合保障先行区为抓手,多维度提升罕见病药品的可及性。2024年11月,上海市发布《上海市医疗保障条例(草案)》,从制度层面引导加强罕见病的诊疗、支付和研究,完善罕见病保障体系。除此之外,各地持续积极探索从支付端入手,保障患者对罕见病药物的需求,具体见表2。
表2 地方发布的加强罕见病供应保障的相关政策
三
灵活监管,应对罕见病药物保障的难题与挑战
罕见病管理的复杂性使我国在该领域仍面临诸多挑战:
一是我国尚未形成科学的罕见病认定标准。全球已发现的罕见病超过8000种,而我国现行罕见病目录仅收录了207种。
二是无药可用问题仍较突出。两批罕见病目录中70%的罕见病尚无任何获批上市的有效疗法,其中30种疾病存在“境外有药、境内无药”的困境。
三是研发成果仍与国际有所差距。国产罕见病药品的替代速度虽有加快,但进口药品仍占据主导地位,且国产药品多为仿制药。
四是支付保障能力不足。我国获批上市的罕见病药品中仍有50余种药物未纳入医保目录,且很多药品年治疗费用在50万元以上甚至超过100万元。
基于我国广阔的市场潜力和罕见病患者保障的公平性需求,同时为促进国内市场的有效循环,特提出以下几点思考。
一是科学界定罕见病范围,更好保障各利益相关方的公平需求。罕见病的界定是制度建设、资源配置以及患者权益保障的重要基础。当前,我国罕见病目录的覆盖范围有限,对那些未被纳入目录但同样属于小众群体的患者缺乏公平性,也不利于激发企业研发相关治疗药物的积极性。为此,建议在当前阶段优先明确罕见病的定义,并在此基础上通过精细化的政策管理,对不同类型、不同发病率的罕见病进行分类支持。如果在短期内难以确定统一的定义,可以考虑为企业提供一个申请认定的通道,搭建起审评部门与企业之间的沟通桥梁,为患病人群相对较小的疾病的药物研发创造更有利的条件。
二是充分利用现有资源,激活协同创新生态。企业、临床机构和科研单位作为罕见病药物研发的核心力量,应进一步深化合作机制,激活临床数据、真实世界数据和生物样本的存量价值,借助人工智能技术提高药物研发能力;同时,研发早期应加强与患者组织的沟通,深入了解患者需求,纳入患者视角的指标,以终为始优化研发路径,从而提高研发效率并提升本土企业的创新水平。
2025年初,北京协和医院与中国科学院自动化研究所共同研发的“协和·太初”罕见病大模型出台。该模型能够准确快速地辅助诊断罕见病,有效破解了罕见病诊疗全国范围内同质性差的问题,是利用大数据和人工智能技术的良好实践典范。
三是优化支付端管理,为企业提供合理回报。足够的经济收益是激励企业加大研发投入的关键。基本医保资金有限且医保的定位是“保基本”,在罕见病药物的保障上天然存在不足,在此背景下,医保丙类目录的设立以及商业保险体系的完善,有望成为提高罕见病患者支付能力的重要补充。
此外,罕见病药物的定价问题也值得关注。部分罕见病药品属于多适应症产品,但在我国现有规定下,同一药品不同适应症的价格一致,忽视了其在不同疾病中的价值差异。因此,建议以罕见病药物为出发点,探索建立结合疾病特点的多适应症多价格管理机制,以更好地平衡企业经济回报、患者用药可及性以及药品价值之间的关系。
总体而言,罕见病虽发病率低,但在中国庞大的人口基数下,患者数量依然可观,呈现出“罕而不少”的特点。面向未来,罕见病药物的研发和医保管理亟需精细化。对于患者人数极少的罕见病,应实施“一病一议”的策略。在确保安全性和科学性的前提下,灵活的监管模式将成为罕见病药物管理的必然选择。
参考资料:
1.RDPAC-蔻德罕见病中心 | 《我国引入境外罕见病药物情况全景梳理》报告解读.https://www.rdpac.org/index.php?r=site/news&id=440
2.国务院办公厅关于全面深化药品医疗器械监管改革促进医药产业高质量发展的意见.
3.医药行业研究报告. 罕见病药物:未来十年医药行业的高增长市场.https://mp.weixin.qq.com/s/4eSjgqZgfFKX05rQqDsy5A
4.蔻德罕见病中心. 时不我待:中国罕见病立法研究报告
5.新报告出炉:孤儿药正在失去光彩吗?
6.Evaluate farmer. The New Report is Out: Are Orphan Drugs Losing their Sparkle?
https://www.evaluate.com/thought-leadership/orphan-drug-report-2024/
7.中国医药创新促进会.关于罕见病目录定位与提升药物创新性、可及性的探讨.
https://mp.weixin.qq.com/s/wSDRCpx4-NUEzHyppnKN1Q
8.2022年罕见病行业发展现状分析 中国罕见病市场有望实现快速增长. https://www.vzkoo.com/read/20220214d41adc1b113ef9af3c0a7b9d.html

 政策法规
政策法规
 中国药审
中国药审  2025-12-12
2025-12-12
 102
102

 政策法规
政策法规
 识林
识林  2025-11-19
2025-11-19
 245
245

 政策法规
政策法规
 中国医药创新促进会
中国医药创新促进会  2025-11-13
2025-11-13
 525
525