 会员动态
会员动态
 医药观澜
医药观澜  2025-04-24
2025-04-24
 2731
2731
今日(4月23日),中国国家药监局药品审评中心(CDE)官网最新公示,正大天晴申报的贝莫苏拜单抗注射液和盐酸安罗替尼胶囊的多项新适应症上市申请获得受理。
贝莫苏拜单抗是一款创新人源化抗PD-L1单克隆抗体,盐酸安罗替尼胶囊是一款口服新型小分子多靶点酪氨酸激酶抑制剂。根据正大天晴公开资料,这项联合疗法已经在多项适应症中取得积极临床研究结果,处于上市申报阶段,包括:
贝莫苏拜单抗注射液联合或不联合盐酸安罗替尼胶囊用于巩固治疗同步/序贯放化疗后未进展的、局部晚期/不可切除(Ⅲ期)的非小细胞肺癌患者;
贝莫苏拜单抗联合化疗后序贯联合盐酸安罗替尼胶囊一线治疗晚期鳞状非小细胞肺癌(sq-NSCLC);
贝莫苏拜单抗注射液联合盐酸安罗替尼胶囊治疗晚期或不可切除腺泡状软组织肉瘤(该项适应症已经被CDE正式纳入优先审评)。
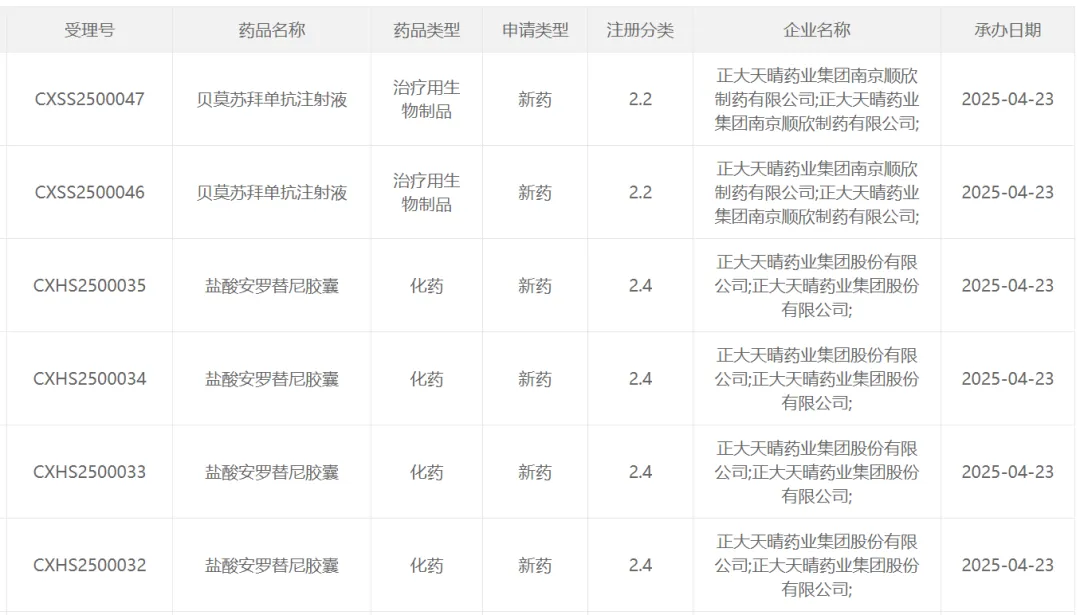
截图来源:CDE官网
贝莫苏拜单抗与安罗替尼联合疗法于2024年5月在中国获批,用于一线治疗广泛期小细胞肺癌(ES-SCLC)患者。于2024年11月在中国获批第二项适应症,用于治疗复发性或转移性子宫内膜癌。2024年8月,贝莫苏拜单抗联合安罗替尼用于一线治疗晚期不可切除或转移性肾细胞癌(RCC)的上市申请也已经获CDE受理。

根据正大天晴公开资料梳理,除了已经获批的适应症,贝莫苏拜单抗与安罗替尼联合疗法还已经在多个其他适应症上取得积极结果:
TQB2450-Ⅲ-05研究(NCT04325763)是一项随机、双盲双模拟、安慰剂平行对照、多中心的3期临床研究,旨在评估贝莫苏拜单抗联合或不联合盐酸安罗替尼胶囊作为巩固治疗在同步/序贯放化疗后未进展的、局部晚期/不可切除(Ⅲ期)NSCLC的有效性和安全性。本研究的期中分析结果显示,相比对照组,试验组可显著降低患者的疾病进展或死亡风险,延长患者无进展生存期(PFS)。其安全性数据与已知风险相符,未发现新的安全性信号。
TQB2450-Ⅲ-12(NCT05718167)是一项多中心、随机、双盲、平行对照的3期临床研究,旨在评估贝莫苏拜单抗注射液联合化疗后序贯联合盐酸安罗替尼胶囊对比一款PD-1抑制剂注射液联合化疗一线治疗晚期鳞状非小细胞肺癌(sq-NSCLC)的有效性和安全性。经独立数据监查委员会(IDMC)判定,主要研究终点无进展生存期(PFS)达到方案预设的优效界值。本研究的期中分析结果显示,与对照组相比,贝莫苏拜单抗联合化疗后序贯联合安罗替尼可显著延长患者的mPFS,降低疾病进展或死亡风险。其安全性数据与已知风险相符,未发现新的安全性信号。

 会员动态
会员动态
 医药观澜
医药观澜  2026-01-29
2026-01-29
 170
170

 会员动态
会员动态
 先声药业
先声药业  2026-01-29
2026-01-29
 171
171

 会员动态
会员动态
 药怪站住
药怪站住  2026-01-28
2026-01-28
 190
190